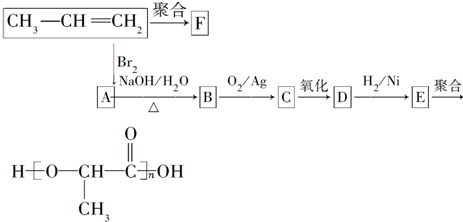
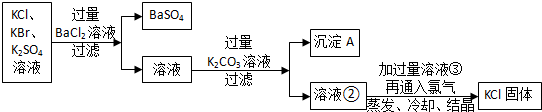
题目内容
下列氢化物的性质按顺序排列正确的是( )
| A、HI、HBr、HCl、HF(酸性减弱) |
| B、HCl、H2S、PH3、SiH4(稳定性减弱) |
| C、H2O、H2S、HCl、HBr(还原性增强) |
| D、HF、H2O、PH3、NH3 (稳定性减弱) |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:气态氢化物中稳定性强弱取决于元素非金属性的强弱,元素的非金属性越强,对应氢化物越稳定.同主族自上而下非金属性减弱,同周期自左而右非金属性增强,非金属性越强,对应最高价氧化物的水化物酸性越强,对应阴离子的还原性越弱,据此选择即可.
解答:
解:A、同主族元素中,随着原子序数的增大,氢化物的酸性逐渐增强,HF、HCl、HBr、HI的酸性依次增强,故A正确;
B、因为元素的非金属性越强,对应氢化物越稳定,Cl、S、P、Si元素的非金属性依次减弱,故氢化物的稳定性依次减弱,故B正确;
C、非金属性越强,对应阴离子的还原性越弱,由于非金属性:O>Cl>Br>S,故还原性强弱顺序为:H2S>HBr>HCl>H2O,故C错误;
D、因为元素的非金属性越强,对应氢化物越稳定,F、O、N、P元素的非金属性依次减弱,故氢化物的稳定性:HF>H2O>NH3>PH3,故D错误,
故选AB.
B、因为元素的非金属性越强,对应氢化物越稳定,Cl、S、P、Si元素的非金属性依次减弱,故氢化物的稳定性依次减弱,故B正确;
C、非金属性越强,对应阴离子的还原性越弱,由于非金属性:O>Cl>Br>S,故还原性强弱顺序为:H2S>HBr>HCl>H2O,故C错误;
D、因为元素的非金属性越强,对应氢化物越稳定,F、O、N、P元素的非金属性依次减弱,故氢化物的稳定性:HF>H2O>NH3>PH3,故D错误,
故选AB.
点评:本题主要考查元素周期律,掌握规律应用是解题的关键,难度中等.

练习册系列答案
相关题目
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、用固体NaOH配制一定物质的量浓度的NaOH溶液时,NaOH溶于水后,应冷却至室温才能转移到容量瓶中 |
将含有等体积NH3、CO2、NO的混合气体依次通过盛有浓H2SO4、Na2O2和Na2CO3溶液的装置,充分反应,最后得到的气体是( )
| A、CO2和NO |
| B、CO2 |
| C、NO |
| D、NO2 |