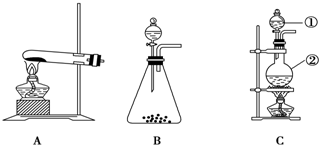
题目内容
如图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:

(1)若用MnO2与浓盐酸反应制取氯气,应选用气体发生装置 ,用化学方程式表示制取氯气的反应原理是 .
(2)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用 溶液浸湿,用化学方程式表示其作用 .
(3)若选用Ⅴ为氯气收集装置,则氯气应从 口通入.
(4)若选用VI为氯气的收集装置,则水槽中的溶液为 .

(1)若用MnO2与浓盐酸反应制取氯气,应选用气体发生装置
(2)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用
(3)若选用Ⅴ为氯气收集装置,则氯气应从
(4)若选用VI为氯气的收集装置,则水槽中的溶液为
考点:常见气体制备原理及装置选择
专题:实验设计题
分析:(1)根据反应物的状态及反应条件确定反应装置;二氧化锰和浓盐酸反应生成氯化锰、氯气和水,注意二氧化锰和浓盐酸反应但不与稀盐酸反应;
(2)根据氯气的性质确定收集方法,注意氯气有毒,不能使氯气逸出污染空气;
(3)根据氯气的密度选择排空气的方法;
(4)饱和食盐水能够降低氯气的溶解度.
(2)根据氯气的性质确定收集方法,注意氯气有毒,不能使氯气逸出污染空气;
(3)根据氯气的密度选择排空气的方法;
(4)饱和食盐水能够降低氯气的溶解度.
解答:
解:(1)二氧化锰和浓盐酸的反应是固液混合加热型,所以选择Ⅰ装置;在加热条件下,二氧化锰和浓盐酸反应生成氯化锰、氯气和水,MnO2+4HC1(浓)
MnC12+C12↑+2H2O,
故答案为:Ⅰ;MnO2+4HC1(浓)
MnC12+C12↑+2H2O;
(2)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:氢氧化钠;2NaOH+Cl2=NaCl+NaClO+H2O;
(3)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口,故答案为:A;
(4)1体积水能够溶解2体积的氯气,不能用排水法收集氯气,饱和食盐水能够降低氯气的溶解度,故可用排饱和食盐水收集氯气,故答案为:饱和食盐水.
| ||
故答案为:Ⅰ;MnO2+4HC1(浓)
| ||
(2)氯气有毒,逸出会污染大气,所以不能让氯气逸出;氯气和水能反应是盐酸和次氯酸,盐酸和次氯酸是酸,都能和碱反应,所以可用氢氧化钠溶液吸收氯气,
故答案为:氢氧化钠;2NaOH+Cl2=NaCl+NaClO+H2O;
(3)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口,故答案为:A;
(4)1体积水能够溶解2体积的氯气,不能用排水法收集氯气,饱和食盐水能够降低氯气的溶解度,故可用排饱和食盐水收集氯气,故答案为:饱和食盐水.
点评:本题考查了氯气的实验室制备原理及装置选择,难度不大,注意根据反应物的状态及反应条件选择相应的装置.

练习册系列答案
相关题目
一定量的甲烷燃烧后得到的产物是CO、CO2和H2O(g),此混合物的质量为49.6g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2g,下列说法正确的是( )
| A、产物中水的质量为25.2g |
| B、产物中CO2的质量为25.2g |
| C、产物中CO2的质量可能超过24.4g |
| D、无法确定参加反应的甲烷的物质的量 |
恒温、恒压下,1molA和n molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成a mol C.则下列说法正确的是( )
| A、物质A的转化率为a |
| B、起始时刻与达到平衡时容器中的体积比为(1+n):(1+n-a) |
| C、反应达到平衡后,再向容器中充入a mol He,物质B的转化率减小 |
| D、当v正(A)=2v逆(C)时,可判断反应达到平衡 |
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等. 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示. 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极.回答下列问题:
如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极.回答下列问题: