题目内容
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答下列问题:
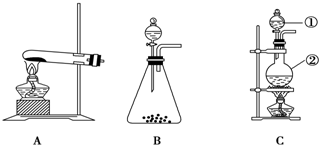
(1)①写出利用上述有关药品制取氨气的化学方程式: ;用 干燥剂干燥(填名称);
②制取CO2的化学方程式 ;
(2)①制取Cl2选用装置为 (填序号);
②写出制取该气体反应的化学方程式 ;
③生成的气体先通过盛 的洗气瓶,除去 气体.
④用湿润的 试纸验满.
⑤写出尾气吸收反应的化学方式 .

(1)①写出利用上述有关药品制取氨气的化学方程式:
②制取CO2的化学方程式
(2)①制取Cl2选用装置为
②写出制取该气体反应的化学方程式
③生成的气体先通过盛
④用湿润的
⑤写出尾气吸收反应的化学方式
考点:常见气体制备原理及装置选择
专题:实验题
分析:(1)①根据氨气性质及制取药品、装置判断;
②二氧化碳用碳酸钙和稀盐酸反应制取,不要选用硫酸,因为生成的硫酸钙附在表面会阻止反应继续进行.
(2)①根据氯气制取装置分析;
②根据氯气制取药品分析;
③根据氯气性质判断;
④根据氯气能氧化KI成I2,I2能使淀粉溶液变蓝分析;
⑤根据氯气的溶液呈酸性分析.
②二氧化碳用碳酸钙和稀盐酸反应制取,不要选用硫酸,因为生成的硫酸钙附在表面会阻止反应继续进行.
(2)①根据氯气制取装置分析;
②根据氯气制取药品分析;
③根据氯气性质判断;
④根据氯气能氧化KI成I2,I2能使淀粉溶液变蓝分析;
⑤根据氯气的溶液呈酸性分析.
解答:
解:(1)①氨气可以利用氯化铵和氢氧化钙加热制取2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,氨气呈碱性,不能使用浓硫酸干燥,氨气能和氯化钙反应,只能用碱性干燥剂碱石灰干燥,故答案为:①2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;碱石灰;
②二氧化碳用碳酸钙和稀盐酸反应制取,CaCO3+2HCl=CaCl2+CO2↑+H2O不要选用硫酸,因为生成的硫酸钙附在表面会阻止反应继续进行,
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)①氯气可以用二氧化锰和浓盐酸微热制取,即装置为固-液加热装置C,故答案为:C;
②二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
③饱和食盐水能降低氯气的溶解度,而氯化氢极易溶解于水,故可用饱和食盐水洗氯气以除去氯化氢气体,
故答案为:饱和食盐水,HCl;
④氯气能使KI氧化生成碘单质,碘单质使淀粉溶液变蓝,故可用湿润的淀粉碘化钾验满,
故答案为:淀粉碘化钾;
⑤氯气水溶液呈酸性,故可用碱性物质氢氧化钠吸收:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
| ||
| ||
②二氧化碳用碳酸钙和稀盐酸反应制取,CaCO3+2HCl=CaCl2+CO2↑+H2O不要选用硫酸,因为生成的硫酸钙附在表面会阻止反应继续进行,
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)①氯气可以用二氧化锰和浓盐酸微热制取,即装置为固-液加热装置C,故答案为:C;
②二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
③饱和食盐水能降低氯气的溶解度,而氯化氢极易溶解于水,故可用饱和食盐水洗氯气以除去氯化氢气体,
故答案为:饱和食盐水,HCl;
④氯气能使KI氧化生成碘单质,碘单质使淀粉溶液变蓝,故可用湿润的淀粉碘化钾验满,
故答案为:淀粉碘化钾;
⑤氯气水溶液呈酸性,故可用碱性物质氢氧化钠吸收:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评:本题考查了常见气体制备原理及装置选择,根据气体的性质选择合适的装置和吸收试剂.

练习册系列答案
相关题目
比较5个SO2分子和5个CO2分子,含量一样的是( )
| A、氧分子 | B、氧原子 |
| C、氧元素 | D、氧气 |
下列各组中化合物的性质比较,不正确的是( )
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4>HBrO4>HIO4 |
| D、非金属性:F>O>S |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,1mol C2H4所含的电子数为12NA |
| B、标准状况下,16g甲烷中共价键数目为4NA |
| C、常温常压,4 g氦气所含的核外电子数为4NA |
| D、16g氧气和臭氧的混合物中含有1.5NA个氧原子 |
