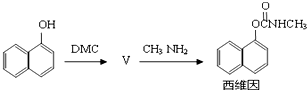
题目内容
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.(1)N、P、S的第一电离能由小到大的顺序为
(2)组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为
(3)Zn2+、Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物.
①基态Zn2+的价电子(外围电子)排布式为
②[Zn(H2O)4]SO4中不存在的化学键类型有
a.配位键 b.金属键 c.共价键 d.氢键 e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(4)由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有
(5)紫外光的光子所具有的能量约为399kJ?mol-根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是
| 共价键 | C-C | C-N | C-S |
| 键能/(kJ?mol-1) | 347 | 305 | 259 |
考点:元素电离能、电负性的含义及应用,判断简单分子或离子的构型,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)同周期自左而右元素的电离能增大,但同周期第ⅡA、ⅤA元素出现反常,同主族从上往下电离能减小;
(2)组成蛋白质的最简单的氨基酸为H2NCH2COOH,根据分子结构来判断π键数目;
(3)①锌原子核外有30个电子,根据构造原理书写;
②[Zn(H2O)4]SO4中锌离子与水分子之间形成配位键,水分子中氧原子与氢原子之间形成极性共价键,络离子与硫酸根离子形成离子键,配体之间形成氢键;
③形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(4)因为杂化杂道是用来容纳σ键与孤电子对,其中采用sp3杂化的原子,σ键数目与孤电子对数目之和为4;
(5)紫外线的能量比蛋白质中主要化学键能量高,使这些化学键断裂破坏蛋白质分子.
(2)组成蛋白质的最简单的氨基酸为H2NCH2COOH,根据分子结构来判断π键数目;
(3)①锌原子核外有30个电子,根据构造原理书写;
②[Zn(H2O)4]SO4中锌离子与水分子之间形成配位键,水分子中氧原子与氢原子之间形成极性共价键,络离子与硫酸根离子形成离子键,配体之间形成氢键;
③形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构;
(4)因为杂化杂道是用来容纳σ键与孤电子对,其中采用sp3杂化的原子,σ键数目与孤电子对数目之和为4;
(5)紫外线的能量比蛋白质中主要化学键能量高,使这些化学键断裂破坏蛋白质分子.
解答:
解:(1)同周期自左而右元素的电离能增大,但同周期第ⅡA、ⅤA元素出现反常,同主族从上往下电离能减小,所以电离能大小的顺序为S<P<N,
故答案为:S<P<N;
(2)H2NCH2COOH,结构中只有1个C=O双键,即π键数目为为1,故答案为:1;
(3)①锌原子核外有30个电子,所以基态Zn2+的价电子(外围电子)排布式为3d10,故答案为:3d10;
②[Zn(H2O)4]SO4中锌离子与水分子之间形成配位键,水分子中氧原子与氢原子之间形成极性共价键,络离子与硫酸根离子形成离子键,配体之间形成氢键,故选b;
③形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,故答案为:a;
(4)因为杂化杂道是用来容纳σ键与孤电子对,其中采用sp3杂化的原子,σ键数目与孤电子对数目之和为4,故答案为:C、N、O;
(5)紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子,
故答案为:紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子.
故答案为:S<P<N;
(2)H2NCH2COOH,结构中只有1个C=O双键,即π键数目为为1,故答案为:1;
(3)①锌原子核外有30个电子,所以基态Zn2+的价电子(外围电子)排布式为3d10,故答案为:3d10;
②[Zn(H2O)4]SO4中锌离子与水分子之间形成配位键,水分子中氧原子与氢原子之间形成极性共价键,络离子与硫酸根离子形成离子键,配体之间形成氢键,故选b;
③形成4个配位键,具有对称的空间构型,可能为平面正方形或正四面体,如为正四面体,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,只有一种结构,所以应为平面正方形,故答案为:a;
(4)因为杂化杂道是用来容纳σ键与孤电子对,其中采用sp3杂化的原子,σ键数目与孤电子对数目之和为4,故答案为:C、N、O;
(5)紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子,
故答案为:紫外光的光子所具有的能量比蛋白质中主要化学键C-C、C-N和C-S的键能都大,紫外线的能量足以使这些化学键断裂,从而破坏蛋白质分子.
点评:本题考查物质结构与性质,题目综合性大,涉及电负性、杂化理论、核外电子排布、化学键、晶胞计算等,难度中等.

练习册系列答案
相关题目
对相同质量的SO2和SO3来说,下列关系正确的是( )
| A、含氧原子个数比为2:3 |
| B、含硫元素质量比为5:4 |
| C、含氧元素质量比为5:6 |
| D、含硫原子个数比为1:1 |
比较5个SO2分子和5个CO2分子,含量一样的是( )
| A、氧分子 | B、氧原子 |
| C、氧元素 | D、氧气 |
下列各组中化合物的性质比较,不正确的是( )
| A、稳定性:PH3>H2S>HCl |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、酸性:HClO4>HBrO4>HIO4 |
| D、非金属性:F>O>S |
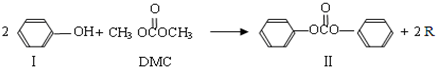
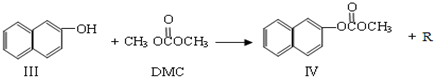
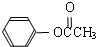 )在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是
)在催化剂作用下也能生成化合物Ⅱ,同时得到一种副产品G,下列有关G的说法正确的是 ),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体
),H的同分异构体有多种,请写出符合下列条件的H的一种同分异构体