题目内容
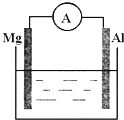 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为两极反应式为:正极
(2)利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池,写出电极反应式.
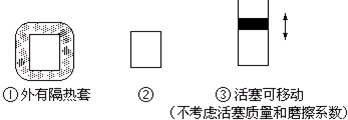
(3)有A、B两种金属分别与盐酸反应,产生氢气的速率相近.怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图,并配有相应的文字说明)
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)原电池反应属于自发的氧化还原反应,失电子的金属做负极,负极金属失电子,发生氧化反应,正极电解质中的阳离子得电子发生还原反应;
(2)先根据反应方程式确定正负极材料,再根据氧化剂确定电解质溶液;
(3)根据活性不同的两个电极、电解质溶液及形成闭合回路来构成原电池,活泼金属作负极,在正极上析出氢气来解答.
(2)先根据反应方程式确定正负极材料,再根据氧化剂确定电解质溶液;
(3)根据活性不同的两个电极、电解质溶液及形成闭合回路来构成原电池,活泼金属作负极,在正极上析出氢气来解答.
解答:
解:(1)镁、铝、稀硫酸形成的原电池将化学能转化为电能,自发的氧化还原反应是金属镁和硫酸之间的反应,镁比铝活泼,金属镁为负极,电极反应为Mg-2e-=Mg2+,金属铝电极是正极,正极上氢离子得电子,发生电极反应:2H++2e-=H2↑,
故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;
(2)Cu+2FeCl3=CuCl2+2FeCl2,该反应中铜是还原剂,还原剂金属单质作负极,所以铜作负极,负极上铜失电子变成铜离子进入溶液,电极反应为:Cu-2e-=Cu2+;不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,正极上三价铁离子得电子生成二价铁离子,发生还原反应,电极反应为:2Fe3++2e-=2Fe2+;氧化剂是氯化铁,氧化剂溶液作电解质溶液,所以选氯化铁溶液作电解质溶液;
答:原电池为 ,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+;
,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+;
(3)电极材料为A、B,电解质溶液为盐酸,用导线将A、B两个电极相连形成的原电池如图为 ,
,
活泼性弱的金属作正极,正极上氢离子得电子发生2H++2e-═H2↑,可观察到有气泡逸出,所以有气泡生成的金属活泼性弱;
答: ,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.
,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.
故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;
(2)Cu+2FeCl3=CuCl2+2FeCl2,该反应中铜是还原剂,还原剂金属单质作负极,所以铜作负极,负极上铜失电子变成铜离子进入溶液,电极反应为:Cu-2e-=Cu2+;不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,正极上三价铁离子得电子生成二价铁离子,发生还原反应,电极反应为:2Fe3++2e-=2Fe2+;氧化剂是氯化铁,氧化剂溶液作电解质溶液,所以选氯化铁溶液作电解质溶液;
答:原电池为
 ,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+;
,负极(Cu):Cu-2e-=Cu2+,正极(C):2Fe3++2e-=2Fe2+;(3)电极材料为A、B,电解质溶液为盐酸,用导线将A、B两个电极相连形成的原电池如图为
 ,
,活泼性弱的金属作正极,正极上氢离子得电子发生2H++2e-═H2↑,可观察到有气泡逸出,所以有气泡生成的金属活泼性弱;
答:
 ,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.
,观察构成的原电池装置,有气泡生成的一极的金属活泼性弱,另一极活泼性强.
点评:本题考查了原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分确定,侧重于考查原电池原理的应用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述错误的是( )
| A、汽车尾气中的NOx是造成光化学烟雾的唯一因素 |
| B、空气中SO2、NOx等是形成酸雨的重要原因 |
| C、冬天撒盐熔雪能造成土壤和水污染 |
| D、河流人海口处形成的三角洲是海水使河水泥沙胶体凝聚的结果 |
将4.6g Cu和Mg完全溶于浓硝酸溶液中,反应中硝酸的还愿产物为4480ml NO2气和336ml N2O4气体(标准状况下),反应后的溶液中,加入过量NaOH溶液,生成沉淀的质量为( )
| A、9.02 g |
| B、8.51 g |
| C、8.26 g |
| D、7.04 g |
某原电池反应的离子方程式为:Fe+2H+=Fe2++H2↑.下列叙述正确的是( )
| A、电解质溶液可能为HNO3 |
| B、正极材料可能为Zn |
| C、正极材料可能为Cu |
| D、负极上:Fe失电子被还原 |