题目内容
原电池是一种 装置.常见Zn-Cu稀硫酸原电池的总反应为:Zn+2H+=Zn2++H2↑
(1)该电池的负极材料是 ,发生的反应是 (填离子反应),反应类型是 反应(填“氧化”或“还原”);
(2)该电池的正极材料是 ,反应现象是 ,反应类型是 (填“氧化”或“还原”)
(1)该电池的负极材料是
(2)该电池的正极材料是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池是将化学能转变为电能的装置,Cu、Zn原电池中,Zn失去电子作负极,被氧化,正极上氢离子得到电子生成氢气,以此来解答.
解答:
解:原电池是一种将化学能转变为电能的装置,故答案为:把化学能转化为电能;
(1)Cu、Zn原电池中,Zn失去电子作负极,被氧化,发生氧化反应,其电极反应式为:Zn-2e-=Zn2+,
故答案为:Zn;Zn-2e-=Zn2+;氧化;
(2)正极上氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑,所以观察到正极上有无色气泡生成;
故答案为:Cu;Cu电极上有气泡生成;还原.
(1)Cu、Zn原电池中,Zn失去电子作负极,被氧化,发生氧化反应,其电极反应式为:Zn-2e-=Zn2+,
故答案为:Zn;Zn-2e-=Zn2+;氧化;
(2)正极上氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑,所以观察到正极上有无色气泡生成;
故答案为:Cu;Cu电极上有气泡生成;还原.
点评:本题考查原电池,明确原电池中的能量转化及电极反应是解答本题的关键,注重基础知识的考查,题目较简单.

练习册系列答案
相关题目
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、CO32- |
| B、c(H+)=1×10-13mol?L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| C、0.1mol?L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、0.1mol?L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
下列说法正确的是( )
| A、2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂和还原剂物质的量之比为1:8 |
| B、2H2S+SO2═3S↓+2H2O中,氧化产物和还原产物的物质的量之比为1:1 |
| C、3S+6KOH═2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2:1 |
| D、5NH4NO3═4N2+2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮原子物质的量之比为5:3 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH
已知:6NiOOH+NH3+H2O+OH-═6Ni(OH)2+NO2-
下列说法正确的是( )
已知:6NiOOH+NH3+H2O+OH-═6Ni(OH)2+NO2-
下列说法正确的是( )
| A、NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、充电过程中OH-离子从阳极向阴极迁移 |
| C、充电过程中阴极的电极反应式:H2O+M+e-═MH+OH-,H2O中的H被M还原 |
| D、NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
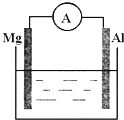 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
 I.下列有关实验的说法不正确的是
I.下列有关实验的说法不正确的是