题目内容
把2.8克铁投入0.1mol/L 200mL的FeCl3溶液中,请回答下列问题:
(1)写出以上反应的离子方程式:
(2)以上反应中氧化产物和还原产物的物质的量之比是:
(3)反应停止后,溶液中Fe2+的物质的量浓度是多少?(忽略溶液体积变化,写出计算过程)
(1)写出以上反应的离子方程式:
(2)以上反应中氧化产物和还原产物的物质的量之比是:
(3)反应停止后,溶液中Fe2+的物质的量浓度是多少?(忽略溶液体积变化,写出计算过程)
考点:化学方程式的有关计算,铁盐和亚铁盐的相互转变
专题:计算题
分析:发生反应:2Fe3++Fe=3Fe2+,氧化产物和还原产物都是Fe2+,由方程式可知,1molFe发生氧化反应得到1molFe2+,2molFe3+发生还原反应得到2molFe2+,根据方程式进行过量计算,根据不足量物质计算溶液中Fe2+的物质的量,进而计算其物质的量浓度.
解答:
解:(1)Fe与氯化铁反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(2)反应中氧化产物和还原产物都是Fe2+,由方程式可知1molFe发生氧化反应得到1molFe2+,2molFe3+发生还原反应得到2molFe2+,故氧化产物和还原产物的物质的量之比是1:2,故答案为:1:2;
(3)2.8克铁的物质的量=
=0.05mol,0.1mol/L 200mL的FeCl3溶液中n(Fe3+)=0.2L×0.1mol/L=0.02mol,由2Fe3++Fe=3Fe2+可知,0.05molFe完全反应消耗Fe3+为0.05mol×2=0.1mol>0.02mol,故Fe有剩余,Fe3+不足,则生成Fe2+的物质的量=0.01mol×3=0.03mol,故溶液中c(Fe2+)=
0.15 mol/L,
答:反应停止后,溶液中Fe2+的物质的量浓度是0.15mol/L.
(2)反应中氧化产物和还原产物都是Fe2+,由方程式可知1molFe发生氧化反应得到1molFe2+,2molFe3+发生还原反应得到2molFe2+,故氧化产物和还原产物的物质的量之比是1:2,故答案为:1:2;
(3)2.8克铁的物质的量=
| 2.8g |
| 56g/mol |
| 0.03mol |
| 0.2L |
答:反应停止后,溶液中Fe2+的物质的量浓度是0.15mol/L.
点评:本题考查氧化还原反应计算、过量计算等,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
下列物质中所有碳原子一定在同一平面上的是( )


| A、①、②、⑤和⑧ |
| B、全部 |
| C、①、②、③、⑤、⑦和⑧ |
| D、①、②、④、⑥和⑧ |
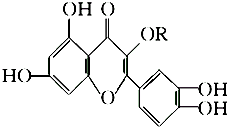 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A、最多可以和含6 molBr2的溴水反应 |
| B、可用有机溶剂萃取 |
| C、分子中有三个苯环 |
| D、1 mol 维生素P可以和4 mol NaOH反应 |
某有机物的结构如图 ,它不具有的官能团是( )
,它不具有的官能团是( )
 ,它不具有的官能团是( )
,它不具有的官能团是( )A、 |
| B、-OH |
| C、 |
| D、-Cl |
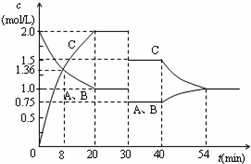 某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)?2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如右图所示.下列说法中正确的是( )
某容积可变的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)?2C(g)+Q(Q>0),容器中物质浓度随时间变化的曲线如右图所示.下列说法中正确的是( )| A、30min时降低温度,40min时升高温度 |
| B、40min~54min之间反应速率v(正)<v(逆) |
| C、设20min和30min时的平衡常数分别为K1和K2,则K1>K2 |
| D、0~8minA的平均反应速率为0.64mol/(L?min) |
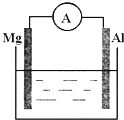 (1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为
(1)如图所示,烧杯中的溶液为稀硫酸,则观察到的现象为