题目内容
5.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
| A. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -═Fe2+ | |
| C. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
分析 燃料电池中,通入燃料的电极是负极,通入氧化剂的电极是正极,则Fe为阴极,C为阳极,精铜为阴极,粗铜为阳极;
A.正极上氧气得电子生成氢氧根离子;
B.阴极上溶液中的阳离子得电子;
C.乙中阴极上氢离子放电生成氢气和氢氧根离子;
D.阳极上活泼性比铜强的金属先失电子,阴极上只有铜离子得电子.
解答 解:燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,则Fe为阴极,C为阳极,精铜为阴极,粗铜为阳极;
A.正极上氧气得电子生成氢氧根离子,所以正极发生的电极反应为O2+4e -+2H2O=4OH-,故A错误;
B.乙装置中铁电极为阴极,阴极上溶液中的阳离子得电子,则阴极电极方程式为2H++2e-═H2↑,故B错误;
C.乙中Fe为阴极,阴极上氢离子放电生成氢气和氢氧根离子,所以乙装置中生成的氢氧化钠在铁极区,故C正确;
D.阳极上活泼性比铜强的金属先失电子,阴极上只有铜离子得电子,由于两极上得失电子守恒,所以溶解的Cu与生成的Cu不相同,则溶液中铜离子浓度减小,故D错误.
故选C.
点评 本题综合考查电解池和原电池知识,注意把握电化学工作原理,侧重于学生的分析能力的考查,有利于培养学生的良好的科学素养,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
15.标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b molNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量( )
| A. | $\frac{a}{2mol}$ | B. | $\frac{a}{22.4-b}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | $\frac{b}{2}$mol |
16.下列物质中,属于高分子化合物的是( )
| A. | C5H12 | B. | (C6H10O5)n | C. | C6H12O6 | D. | C12H22O11 |
20.某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究.
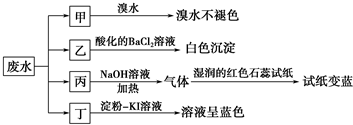
已知废水试样中可能含有下表中的离子:
(1)离子X是NH4+(填化学式,下同),离子Y是SO42-.
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为取少量废水试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在.
(3)丁组实验在酸性条件下发生反应的离子方程式是6I-+2NO3-+8H+=2NO↑+3I2+4H2O.

已知废水试样中可能含有下表中的离子:
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为取少量废水试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在.
(3)丁组实验在酸性条件下发生反应的离子方程式是6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
10.在两支试管中各加入10mL溴水,再分别加入5mL正己烷(分子式为C6H14,结构简式为CH3CH2CH2CH2CH2CH3).将一支试管中的混合液在避光处振荡后静置,液体分为两层,上层是橙红色的溴的己烷溶液,下层是几乎褪成无色的稀溴水.将另一支试管中的混合液在光照下振荡后静置,溶液也分层,上、下两层液体几乎均是无色的,用玻璃棒蘸取浓氨水伸入该试管内液面上方,产生白烟.下列对己烷性质的描述正确的是( )
| A. | 己烷的密度比水大,且难溶于水 | B. | 己烷在光照时能发生取代反应 | ||
| C. | 己烷在光照时能发生加成反应 | D. | 己烷不易燃烧,可作为灭火剂 |
17.下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是( )


| A. | Ca(ClO)2 | B. | 氯水 | C. | NaOH | D. | 浓HCl |
14.下列叙述不正确的是( )
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 铁船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 把锌片放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |