题目内容
15.标准状况下,将aLH2和Cl2的混合气体点燃,充分反应后,将混合气体通入含b molNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO3-,且三者物质的量之比为8:1:1,则原混合气体中H2的物质的量( )| A. | $\frac{a}{2mol}$ | B. | $\frac{a}{22.4-b}$mol | C. | ($\frac{a}{22.4}$-$\frac{b}{2}$)mol | D. | $\frac{b}{2}$mol |
分析 将混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO3-),根据氯元素守恒,计算aLH2和Cl2的混合气体中氯气的物质的量,aLH2和Cl2的混合气体总的物质的量减去氯气的物质的量即为氢气的物质的量,由此分析解答.
解答 解:混合气体通入含bmolNaOH的热溶液中,气体恰好被完全吸收,NaOH无剩余,测得反应后溶液中含Cl-、ClO-、ClO-3,根据电荷守恒可知,溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO3-),根据氯元素守恒可知,aLH2和Cl2的混合气体中n(Cl2)=$\frac{1}{2}$[n(Cl-)+n(ClO-)+n(ClO3-)]=$\frac{1}{2}$n(Na+)=$\frac{1}{2}$bmol,所以aLH2和Cl2的混合气体中n(H2)=($\frac{a}{22.4}$-$\frac{b}{2}$)mol,故选C.
点评 本题考查氧化还原反应的计算,难度中等,判断溶液中n(Na+)=n(Cl-)+n(ClO-)+n(ClO3-)是解题关键.

练习册系列答案
相关题目
2.将ag二氧化锰粉末加入cL bmol•L-1的浓盐酸中,加热完全溶解,反应中转移电子d个.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到标准状况下氯气5.6bcL | |
| B. | 反应后Cl-数目为bc-d | |
| C. | NA可表示为$\frac{2a}{87d}$ | |
| D. | 反应后溶液中的H+的物质的量为(bc-$\frac{2d}{{N}_{A}}$)mol |
6. 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A. | 充分燃烧等质量的X和甲烷,X消耗氧气较多 | |
| B. | X中碳原子在同一平面上 | |
| C. | X和乙烷类似,都容易发生取代反应 | |
| D. | X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 |
10.下列对元素周期表说法不正确的是( )
| A. | 在第ⅥB和第ⅦB族附近可以找到耐高温金属材料 | |
| B. | 第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性 | |
| C. | 如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置 | |
| D. | 目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质 |
20.下列关于糖类、油脂、蛋白质的说法不正确的是( )
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 分子式为C2H6和C5H12的两种有机物一定互为同系物 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
4.分类是学习和研究化学的一种常用的科学方法.下列分类合理的是( )
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②根据丁达尔现象可将分散系分为胶体、溶液和浊液
③Al2O3是两性氧化物,能与NaOH溶液反应
④根据反应的热效应将化学反应分为放热反应和吸热反应.
①根据酸分子中含有H原子个数将酸分为一元酸、二元酸等
②根据丁达尔现象可将分散系分为胶体、溶液和浊液
③Al2O3是两性氧化物,能与NaOH溶液反应
④根据反应的热效应将化学反应分为放热反应和吸热反应.
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ①②③ |
5.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
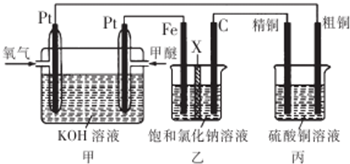

| A. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -═Fe2+ | |
| C. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |