题目内容
17.下列物质的溶液在空气中长期放置,其pH的变化与图示相符的是( )
| A. | Ca(ClO)2 | B. | 氯水 | C. | NaOH | D. | 浓HCl |
分析 由图象可知,物质pH<7,呈酸性,溶液在空气中长期放置,pH逐渐减小,说明溶液酸性逐渐增起,结合对应物质的性质解答该题.
解答 解:A.Ca(ClO)2为强碱弱酸盐,溶液呈碱性,故A错误;
B.氯水中含有盐酸和次氯酸,次氯酸不稳定,见光易分解,生成氧气和盐酸,溶液酸性增强,pH减小,故B正确;
C.NaOH溶液呈碱性,故C错误;
D.浓HCl易挥发,露置空气中浓度逐渐减小,pH逐渐增大,故D错误;
故选B.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
8.下列关于乙烯的化学性质的叙述中,不正确的是( )
| A. | 能使溴水褪色 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 能与醋酸发生酯化反应 | D. | 能发生加聚反应 |
5.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )


| A. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -═Fe2+ | |
| C. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
2.下列关于NH4+、NH3、NH2-三种微粒的说法不正确的是( )
| A. | 三种微粒所含有的电子数相等 | B. | 三种微粒中氮原子的杂化方式相同 | ||
| C. | 三种微粒的空间构型相同 | D. | 键角大小关系:NH4+>NH3>NH2- |
9.某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究.
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定.在加热的条件下,它能分解生成氧气.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生.
(1)上述实验发生反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
(2)实验甲和实验乙的实验目的是探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊的实验目的是探究在不同酸碱性条件下,催化剂对反应速率的影响.
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
①对实验戊,0~20s的反应速率v1=0.775mL/s,100~120s的反应速率v2=0.575mL/s.不考虑实验测量误差,二者速率存在差异的主要原因是随反应的不断进行,H2O2溶液的浓度逐渐降低,反应速率减小.
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验丁(填“丙”、“丁”或“戊”).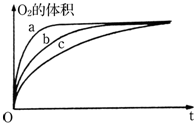
| 实验编号 | 反应物 | 催化剂 |
| 甲 | 试管中加入3mL 2%H2O2溶液和3滴蒸馏水 | 无 |
| 乙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 无 |
| 丙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 1mL 0.1mol/L FeCl3溶液 |
| 丁 | 试管中加入3mL 5%H2O2溶液和3滴稀盐酸溶液 | 1mL 0.1mol/L FeCl3溶液 |
| 戊 | 试管中加入3mL 5%H2O2溶液和3滴NaOH溶液 | 1mL 0.1mol/L FeCl3溶液 |
(1)上述实验发生反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
(2)实验甲和实验乙的实验目的是探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊的实验目的是探究在不同酸碱性条件下,催化剂对反应速率的影响.
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
| 时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
| 气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
| 实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
| 实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验丁(填“丙”、“丁”或“戊”).

6.链型的不饱和油酸(C17H33COOH)与蔗糖反应可以制得非天然油脂,其反应示意图如图所示(图中的反应式不完整),则下列说法不正确的是( )


| A. | 该非天然油脂与氢氧化钠溶液共热,产物可与溴的四氯化碳溶液反应 | |
| B. | 天然油脂、蔗糖、非天然油脂都能发生水解反应 | |
| C. | 蔗糖、葡萄糖分别与银氨溶液水浴加热反应,有相同的实验现象 | |
| D. | 植物油、非天然油脂都可以与H2发生加成反应 |
3.能够可把苯酚、乙醇、氢氧化钠溶液鉴别出来的试剂是( )
| A. | 碳酸钠溶液 | B. | 酸性高锰酸钾溶液 | ||
| C. | 酚酞溶液 | D. | FeCl3溶液 |

 .
.