题目内容
20.某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究.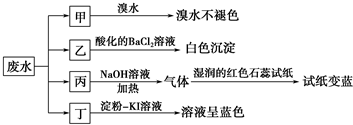
已知废水试样中可能含有下表中的离子:
| 阳离子 | Na+、Mg2+、X |
| 阴离子 | Cl-、SO32-、Y、NO3- |
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为取少量废水试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在.
(3)丁组实验在酸性条件下发生反应的离子方程式是6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
分析 由实验可知,甲中加入溴水不褪色,证明不含还原性离子,推断不含SO32-,乙中加入酸化的氯化钡生成白色沉淀说明含有SO42-,丙中加入氢氧化钠溶液加热反应生成气体使湿润的红色石蕊试纸变蓝色,证明是氨气,说明原溶液中含有NH4+,丁中加入淀粉碘化钾溶液后溶液呈蓝色说明溶液中含有氧化性离子能氧化碘离子为单质碘,判断含有NO3-,
(1)离子X为NH4+,离子Y为SO42-;
(2)表中不能确定是否存在的阴离子是Cl-,依据氯离子的检验方法设计实验验证;
(3)丁组实验在酸性条件下发生反应是废水试样中滴加淀粉一KI溶液所发生反应,硝酸具有氧化性氧化碘离子为碘单质.
解答 解:甲中加入溴水不褪色,证明不含还原性离子,推断不含SO32-;乙中加入酸化的氯化钡生成白色沉淀说明含有SO42-;丙中加入氢氧化钠溶液加热反应生成气体使湿润的红色石蕊试纸变蓝色,证明是氨气,说明原溶液中含有NH4+;丁中加入淀粉碘化钾溶液后溶液呈蓝色说明溶液中含有氧化性离子能氧化碘离子为单质碘;判断含有NO3-;
(1)离子X为NH4+,离子Y为SO42-,故答案为:NH4+;SO42-;
(2)表中不能确定是否存在的阴离子是Cl-,能证明该阴离子是否存在的简单实验操作为,取少量溶液与试管中,加入稀硝酸,再加入硝酸银溶液生成白色沉淀证明氯离子的存在Cl-,
故答案为:Cl-;取少量废水试样,滴加足量的Ba(NO3)2溶液,静置;取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-,若无白色沉淀产生,则不存在Cl-;
(3)丁组实验在酸性条件下发生反应是废水试样中滴加淀粉一KI溶液发生反应,硝酸根离子在酸溶液中发生氧化还原反应,反应的离子方程式:6I-+2NO3-+8H+=2NO↑+3I2+4H2O,
故答案为:6I-+2NO3-+8H+=2NO↑+3I2+4H2O.
点评 本题考查了离子检验的实验现象分析判断,离子共存分析,离子性质熟练掌握是解题关键,题目难度中等,

| A. | 在第ⅥB和第ⅦB族附近可以找到耐高温金属材料 | |
| B. | 第ⅣA族所有含氧酸的钠盐,溶于水均呈碱性 | |
| C. | 如果已知元素的最外层电子数为2,由此不能判断该元素在周期表中的位置 | |
| D. | 目前已知发现的第ⅣA族元素为5种,所以该族元素共有5种单质 |
①SiO2+2C═Si+2CO↑
②Si+2Cl2═SiCl4
③SiCl4+2H2═Si+4HCl
下列对上述三个反应的叙述正确的是( )
| A. | ①②③均为置换反应 | |
| B. | ①②③均为氧化还原反应 | |
| C. | 在工业生产中若只发生反应①,则在产品硅中可能混有SiC | |
| D. | 三个反应的反应物中硅元素均被氧化 |
| A. | 能使溴水褪色 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 能与醋酸发生酯化反应 | D. | 能发生加聚反应 |
| A. | 用石墨作电极电解CuSO4溶液,通电一段时间后,在标准状况下两极产生的气体可能相等 | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 电解池中的阳极和原电池中的负极上都发生还原反应 |
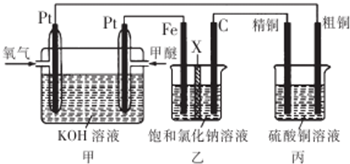
| A. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -═Fe2+ | |
| C. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
| 实验编号 | 反应物 | 催化剂 |
| 甲 | 试管中加入3mL 2%H2O2溶液和3滴蒸馏水 | 无 |
| 乙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 无 |
| 丙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 1mL 0.1mol/L FeCl3溶液 |
| 丁 | 试管中加入3mL 5%H2O2溶液和3滴稀盐酸溶液 | 1mL 0.1mol/L FeCl3溶液 |
| 戊 | 试管中加入3mL 5%H2O2溶液和3滴NaOH溶液 | 1mL 0.1mol/L FeCl3溶液 |
(1)上述实验发生反应的化学方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
(2)实验甲和实验乙的实验目的是探究反应物的不同浓度对反应速率的影响;实验丙、实验丁和实验戊的实验目的是探究在不同酸碱性条件下,催化剂对反应速率的影响.
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
| 时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
| 气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
| 实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
| 实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验丁(填“丙”、“丁”或“戊”).


 .
.