题目内容
4.标准状况下,测得38.4g某气体的体积为13.44L,计算该气体的相对分子质量.分析 结合n=$\frac{V}{Vm}$、M=$\frac{m}{n}$及摩尔质量与相对分子质量的数值相同来解答.
解答 解:标准状况下,Vm=22.4L/mol,则气体的物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,M=$\frac{38.4g}{0.6mol}$=64g/mol,则该气体的相对分子质量为64,
答:该气体的相对分子质量为64.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意摩尔质量与相对分子质量的关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
| 装置 | 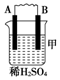 |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
(1)装置甲中负极的电极反应式是A-2e-═A2+.
(2)装置乙中正极的电极反应式是Cu2++2e-═Cu.
(3)装置丙中溶液的pH变大(填“变大”、“变小”或“不变”).
20.已知H2CO3的Ka1=4.2×l0-7.室温下,H2SeO4存在以下电离过程:H2SeO4=H++HSeO4-;HSeO4-?H++SeO42-,K=1.2×10-2.下列相关叙述正确的是( )
| A. | NaHSeO4溶液和Na2SeO4溶液均显碱性 | |
| B. | pH=3的H2SeO4和NaHSeO4溶液,后者水的电离程度大 | |
| C. | H2SeO4溶液中滴加少量氨水的离子方程式:H++NH3•H2O=NH4++H2O | |
| D. | Na2CO3溶液中加入少量H2SeO4的离子方程式为:CO32-+H+=HCO3- |
9.下列关于某些离子的检验说法中正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有 CO32- | |
| B. | 某溶液与浓 NaOH 溶液共热,产生使湿润蓝色石蕊试纸变红气体,则原溶液中存在 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO 42- | |
| D. | 可用硝酸酸化的 AgNO3 溶液鉴别 Cl-、Br-、I- |
16.下列解释事实的方程式不正确的是( )
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
14.0.6mol/LNaCl溶液和1mol/LCaCl2溶液的c (Cl-)之比为( )
| A. | 2:5 | B. | 3:10 | C. | 1:2 | D. | 3:5 |

 ;
;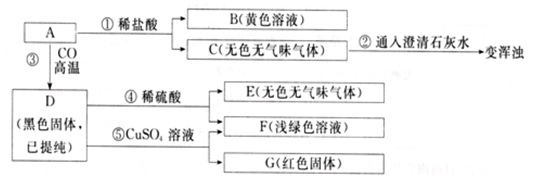
 A~H为中学化学中常见物质,他们之间的转化关系如图所示.其中常温下A为固态非金属单质;C为无色有刺激性气味的气体,D和G为无色、无味的气体,且C和D均能使澄清石灰水变浑浊;E常温下为无色、无味的液体;F为淡黄色粉末.
A~H为中学化学中常见物质,他们之间的转化关系如图所示.其中常温下A为固态非金属单质;C为无色有刺激性气味的气体,D和G为无色、无味的气体,且C和D均能使澄清石灰水变浑浊;E常温下为无色、无味的液体;F为淡黄色粉末.