题目内容
20.已知H2CO3的Ka1=4.2×l0-7.室温下,H2SeO4存在以下电离过程:H2SeO4=H++HSeO4-;HSeO4-?H++SeO42-,K=1.2×10-2.下列相关叙述正确的是( )| A. | NaHSeO4溶液和Na2SeO4溶液均显碱性 | |
| B. | pH=3的H2SeO4和NaHSeO4溶液,后者水的电离程度大 | |
| C. | H2SeO4溶液中滴加少量氨水的离子方程式:H++NH3•H2O=NH4++H2O | |
| D. | Na2CO3溶液中加入少量H2SeO4的离子方程式为:CO32-+H+=HCO3- |
分析 A.H2SeO4=H++HSeO4-,第一步完全电离,HSeO4-不水解;
B.pH=3的H2SeO4和NaHSeO4溶液,氢离子浓度相同,对水的电离影响程度相同;
C.H2SeO4溶液中滴加少量氨水反应生成酸式盐NaHSeO4,H2SeO4=H++HSeO4-,第一步完全电离;
D.已知HSeO4-?H++SeO42-,K2=1.2×10-2大于H2CO3的一级电离常数分别为Kl=4.2×10-7,所以KHCO3和KHSeO4两溶液混合,强酸制弱酸生成二氧化碳不能存在.
解答 解:A.H2SeO4=H++HSeO4-,第一步完全电离,HSeO4-不水解,NaHSeO4溶液显酸性,Na2SeO4溶液显碱性,故A错误;
B.pH=3的H2SeO4和NaHSeO4溶液,氢离子浓度相同,对水的电离影响程度相同,水的电离程度相同,故B错误;
C.H2SeO4溶液中滴加少量氨水反应生成酸式盐NaHSeO4,H2SeO4=H++HSeO4-,第一步完全电离,氨水少量所以第一步完全电离产生的氢离子,还过量,H2SeO4溶液中滴加少量氨水的离子方程式:H++NH3•H2O=NH4++H2O,故C正确;
D.已知HSeO4-?H++SeO42-,K2=1.2×10-2大于H2CO3的一级电离常数分别为Kl=4.2×10-7,所以HCO3-和HSeO4-两溶液混合,强酸制弱酸不能共存,所以反应方程式为:CO32-+H2SeO4-=CO2↑+SeO42-+H2O,故D错误;
故选C.
点评 本题考查较为综合,涉及物质的量程度分析、产物判断、电离平衡常数比较等知识,题目难度中等,注意判断反应物和生成物,用守恒的方法和原理书写离子方程式.

练习册系列答案
相关题目
10.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  实验室制氨气 | ||
| C. |  排水集气法收集NO | D. |  除去Cl2中的HCl |
8.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论错误的是( )
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有 Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加人适量CaO粉末,充分反应后观察到有白色沉淀生成,说明 原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液后有白色沉淀生成,这个现象不能说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了 0.620g.用足童稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
15.某溶液中含有大量的H+、NO3-、Ba2+,在该溶液中还可能大量存在的离子是( )
| A. | Ca2+ | B. | SO32- | C. | SiO32- | D. | Fe2+ |
12.${\;}_{92}^{235}$U是重要的核工业原料,下列有关${\;}_{92}^{235}$U的说法正确的是( )
| A. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同素异形体 | |
| B. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同位素 | |
| C. | ${\;}_{92}^{235}$U原子核中含有92个中子 | |
| D. | ${\;}_{92}^{235}$U原子核外有143个电子 |
5.下列说法正确的是( )
| A. | 石墨是电解质 | B. | 干冰是氧化物 | C. | 铝热剂是纯净物 | D. | 胆矾是混合物 |
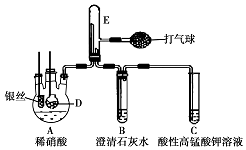 某化学实验小组利用如图装置证明银和稀硝酸反应产生NO,D是内置块状大理石的多孔玻璃笼.(加热装置和夹持装置均已略去.
某化学实验小组利用如图装置证明银和稀硝酸反应产生NO,D是内置块状大理石的多孔玻璃笼.(加热装置和夹持装置均已略去.