题目内容
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹.
(1)硅在元素周期表中的位置是 .
(2)工业生产粗硅的反应有SiO2+2C
Si(粗)+2CO↑,SiO2+3C
SiC+2CO↑.若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的物质的量之比为 .
(3)工业上可以通过如下图所示的流程制取纯硅.
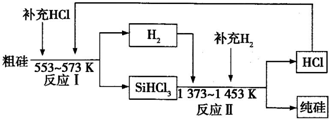
①若反应Ⅰ为Si(粗)+3HCl
SiHCl3+H2,则反应Ⅱ的化学方程式为 .
②整个制备过程中必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式: .
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是 .
(1)硅在元素周期表中的位置是
(2)工业生产粗硅的反应有SiO2+2C
| ||
. |
| ||
. |
(3)工业上可以通过如下图所示的流程制取纯硅.

①若反应Ⅰ为Si(粗)+3HCl
| ||
②整个制备过程中必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式:
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应Ⅰ中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比是
考点:硅和二氧化硅
专题:碳族元素
分析:(1)硅原子序数为14;
(2)根据方程式中碳和二氧化硅、硅、碳化硅之间的关系式计算;
(3)①根据反应物、生成物和反应条件写出反应方程式;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;
③反应生产1mol纯硅需补充HCl:
-3,需补充H2:
-1.
(2)根据方程式中碳和二氧化硅、硅、碳化硅之间的关系式计算;
(3)①根据反应物、生成物和反应条件写出反应方程式;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;
③反应生产1mol纯硅需补充HCl:
| 3 |
| 90% |
| 1 |
| 93.95% |
解答:
解:(1)硅原子序数为14,位于第三周期,第ⅣA族,
故答案为:第三周期,第ⅣA族;
(2)根据反应方程式生成1mol Si需C 2mol、SiO2 1mol,生成1mol SiC需C 3mol,SiO2 1mol,产品中Si与SiC的物质的量之比为1:1,则参加反应的C和SiO2物质的量之比为5:2,
故答案为:5:2;
(3)①由工艺流程可知,反应Ⅱ是氢气与SiHCl3反应生成Si(纯)、HCl,反应方程式为:SiHCl3+H2
Si(纯)+3HCl,
故答案为:SiHCl3+H2
Si(纯)+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
③反应生产1mol纯硅需补充HCl:
-3,需补充H2:
-1,补充HCl与H2的物质的量之比为≈5:1.
故答案为:5:1.
故答案为:第三周期,第ⅣA族;
(2)根据反应方程式生成1mol Si需C 2mol、SiO2 1mol,生成1mol SiC需C 3mol,SiO2 1mol,产品中Si与SiC的物质的量之比为1:1,则参加反应的C和SiO2物质的量之比为5:2,
故答案为:5:2;
(3)①由工艺流程可知,反应Ⅱ是氢气与SiHCl3反应生成Si(纯)、HCl,反应方程式为:SiHCl3+H2
| ||
故答案为:SiHCl3+H2
| ||
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;
③反应生产1mol纯硅需补充HCl:
| 3 |
| 90% |
| 1 |
| 93.95% |
故答案为:5:1.
点评:本题考查硅及其化合物的性质,题目难度不大,计算是该题的难点.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、足量Cl2通入FeBr2溶液中:2Br-+Cl2=Br2+2Cl- |
| B、用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO-+CO(NH2)2=3Cl-+CO2↑+N2↑+2H2O |
| C、过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O=H2SiO3↓+CO32- |
| D、Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
下列反应的离子方程式书写正确的是( )
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B、将碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
| C、将1 mol?L-1的NaAlO2溶液和2.5 mol?L-1的HCl溶液等体积均匀混合:AlO2-+H++H2O=Al(OH)3↓ |
| D、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+恰好完全沉淀2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
下列化学反应的离子方程式正确的是( )
| A、石灰石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
| C、将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+═2As+3SnCl62-+6M,关于该反应的说法中正确的是( )
| A、氧化剂是H3AsO3 |
| B、还原性:Cr>As |
| C、每生成1mol As,反应中转移电子的物质的量为6mol |
| D、M为OH- |
某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
| A、0.1mol/L HCN的溶液,其pH>1 |
| B、CN-可被Cl2氧化成(CN)2 |
| C、在水溶液中(CN)2可被F-还原 |
| D、HCN的结构式为H-C≡N |
设nA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,2.24L SO3含有的分子数为0.1nA |
| B、常温下,3.0g甲醛含有C-H键数目为0.2nA |
| C、含有2mol H2SO4的浓硫酸与足量Cu在加热条件下充分反应,电子转移数是2nA |
| D、1L 1mol/L AlCl3溶液含Al3+数目为nA |
 2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!