题目内容
7.有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下表:| 元素编号 | 特征信息 |
| A | 有一种原子内只有质子,没有中子 |
| B | L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3 |
| D | 最外层电子数等于电子层数,且是地壳中含量较多的元素之一 |
| E | 单质为黄绿色,可用于制造漂白粉 |
(1)A、B、C三种元素形成的化合物含有的化学键类型是离子键、(极性)共价键.
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)D单质与A、E形成的化合物的水溶液反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(4)写出实验室制取单质E的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(5)C和D两元素形成的单质活泼性较强的是(写元素符号)Na,你的判断依据是Na可与冷水剧烈反应,Al不与水反应.
分析 A、B、C、D、E五种原子序数小于18的元素,A其中一种原子核内只有质子没有中子,则A为H元素;B原子的L层电子数是K层的3倍,其L层含有6个电子,为O元素;C阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3,则C为Na元素;D原子的最外层电子数等于电子层数,且是地壳中含量较多的元素之一,则为Al元素;E单质为黄绿色气体,可用于制造漂白粉,则E为Cl元素,据此进行解答.
解答 解:A、B、C、D、E五种原子序数小于18的元素,A其中一种原子核内只有质子没有中子,则A为H元素;B原子的L层电子数是K层的3倍,其L层含有6个电子,为O元素;C阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3,则C为Na元素;D原子的最外层电子数等于电子层数,且是地壳中含量较多的元素之一,则为Al元素;E单质为黄绿色气体,可用于制造漂白粉,则E为Cl元素,
(1)由H、O、Na三种元素形成的化合物是氢氧化钠,氢氧化钠中含有离子键和共价键,
故答案为:离子键、(极性)共价键;
(2)由H、O、Na元素中两两组合形成的化合物为过氧化钠和水,因为过氧化钠和水能反应生成氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)D的单质为Al,A、E形成的化合物为HCl,铝与盐酸反应生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(4)E的单质为氯气,实验室中常用二氧化锰与浓盐酸反应制取氯气,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)C的单质为Na,D的单质为金属铝,Na可与冷水剧烈反应,Al不与水反应,则金属钠的活泼性较强,
故答案为:Na;Na可与冷水剧烈反应,Al不与水反应.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的综合应用能力.

| A. | 蒸馏 | B. | 升华 | C. | 萃取 | D. | 蒸发 |
I.“保险粉”(Na2S2O4)易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定.它的制备工艺流程如图所示,请按要求回答下列问题.
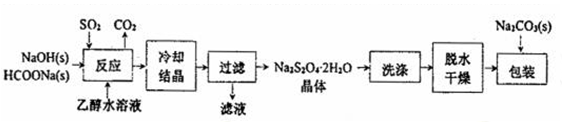
(1)“反应”在70℃条件下进行,写出发生反应的离子方程式:HCOO-+OH-+2SO2=S2O42-+CO2+H2O.
(2)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是Na2CO3为碱性物质,提高“保险粉”的稳定性.
(3)现将10mL 0.050mol/L Na2S2O4溶液在空气中放置,其溶液的pH与时间(t)的关系如图所示:(忽略溶液体积的变化).
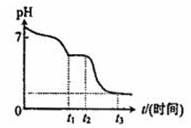
①t1~t2段溶液中S元素的化合价为+4.
②t3时刻后溶液的pH为1.
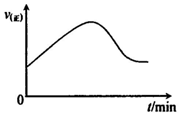
Ⅱ.由工业制硫酸反应之一:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g),推测此反应的△S(填“>”或“<”)<0,△H(填“>”或“<”)<0.
(l)若在绝热恒容密闭容器中,通入一定量的SO2和O2,一定条件下反应,请在如下坐标中画出从开始经一段时间正反应速率[v(正)]随时间(t)的变化曲线图:

(2)若在相同条件下,分别投2molSO2(g)和1molO2(g) 于如下三容器中:
| 绝热恒容(2L ) 密闭容器A | 恒温(T℃)恒容(2L) 密闭容器B | 恒温(T℃)恒压 密闭容器C | |
| 平衡常数K | KA | KB | KC |
| SO2的平衡转化率 | αA | αB | αC |
| A. | 元素B的化合物可以用来做焰火材料 | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 工业上常用电解法制备元素C、D、E的单质 | |
| D. | 元素B、D的最高价氧化物对应的水化物之间可能发生反应 |
②C(s)+2H2(g)?CH4(g)△H=-73KJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171 KJ•mol-1
则CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)其他条件相同时,CO和H2按物质的量比1:3进行反应:CO(g)+3H2(g)?CH4(g)+H2O(g)
H2的平衡转化率在不同压强下,随温度的变化如图1所示.

①实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由与N点条件相比,选用M点条件时,虽然H2转化率低些,但温度较高,反应速率较快,压强为常压对设备要求不高,综合成本低.
②M点的平衡常数Kp=$\frac{\frac{0.9}{2.2}×1.01×1{0}^{5}×\frac{0.9}{2.2}×1.01×1{0}^{5}}{\frac{0.1}{2.2}×1.01×1{0}^{5}×(\frac{0.3}{2.2}×1.01×1{0}^{5})^{3}}$.(只列算式.Kp的表达式是将平衡分压代替平衡浓度.某物质的平衡分压=总压×该物质的物质的量分数)
(3)图2表示在一定条件下的1L的密闭容器中,X、Y、C三种气体因发生反应,三种气体的物质的量随时间的变化情况.表一是3mol X和1mol Y在一定温度和一定压强下反应,达到平衡时C的体积分数(C%).
表一:
| 温度/℃C% 压强/MPa | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
②表中a的取值范围是25.1<a<64.2.
③根据图和表分析,25min~40min内图中曲线发生变化的原因可能是缩小容器体积或增大压强.
(4)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如表二所示.
表二:
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
①NaHSO3②HNO2③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如图3所示.其中符合曲线Ⅱ的溶液为①③.
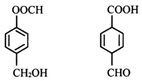
| A. | 均可发生取代、加成反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 分子中共平面的碳原子数相同 | |
| D. | 互为同分异构体,可用NaHCO3溶液鉴别 |
| A. | Na$→_{点燃}^{O_{2}}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3 | B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | ||
| C. | NaCl(aq)$\stackrel{电解}{→}$Cl2$→_{△}^{过量Fe}$FeCl2(s) | D. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
| A. | Na2S2O3溶液与H2SO4溶液混合:S2O32-+4H+═SO42-+S↓+2H2O | |
| B. | 硝酸银溶液中滴入少量氨水:Ag++2NH2•H2O═[Ag(NH3)2]++2H2O | |
| C. | AgI悬浊液中滴入适量Na2S溶液:2AgI+S2-═Ag2S+2I- | |
| D. | Fe(SCN)3溶液中滴入几滴0.01mol/LNaOH溶液:Fe3++3OH-═Fe(OH)3↓ |