题目内容
7.下列叙述不正确的是( )D工业上电解饱和食盐水的.| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
分析 A、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出;
B、在原电池中,活泼的做负极;
C、钢铁的吸氧腐蚀中,正极上氧气放电;
D、电解饱和食盐水时,阳极上氯离子放电.
解答 解:A、在铁表面镀锌,需要将锌先反应为锌离子,然后在铁表面析出,故锌应做阳极,故A正确;
B、在原电池中,活泼的做负极,与轮船形成原电池,船体做正极被保护,故B错误;
C、钢铁的吸氧腐蚀中,正极上氧气放电,电极反应为:O2+2H2O+4e-═4OH-,故C正确;
D、电解饱和食盐水时,阳极上氯离子放电,电极反应为2Cl--2e-═Cl2↑,故D正确.
故选B.
点评 本题考查了电化学腐蚀与防护,应注意的是在原电池中正极被保护、在电解池中阴极被保护,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.10gNaOH溶解于90g水中,溶液内含有H元素的物质的量是( )
| A. | 0.25mol | B. | 10.25mol | C. | 10mol | D. | 0.5mol |
18.某溶液里存有NH4+Fe3+ Cu2+ Cl- SO42-离子,溶液不浑浊的是( )
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
2.下列离子方程式正确的是( )
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | Fe3O4与HCl:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | Fe2O3与Hl:Fe2O3+6H+═2Fe3++3H2O |
12.当线型高分子链上如果还有能起反应的官能团时,在一定条件下就会形成体型高分子结构.下列有机物在一定条件下通过反应最终可能得到体型结构的高分子化合物的是( )
| A. | CH2=CH2 | B. | CH3COOH | C. | CH2=CHClC=CH2 | D. | CH2=CHCH2OH |
19.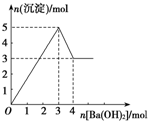 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
 如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示向某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A. | MgSO4 | B. | KAl(SO4)2 | C. | Al2(SO4)3 | D. | Na AlO2 |
16.下列实验中,所选药品和装置不合理的是( )
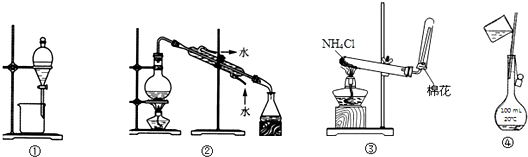

| A. | 选①可用于CC14提取碘水中的碘 | |
| B. | 选②可用于自来水制取蒸馏水 | |
| C. | 选③可用于实验室制取氨气 | |
| D. | 选④可用于配制100 mL 0.1 mol/L NaCl溶液(转移溶液) |
17.铜及其化合物在工农业生产及日常生活中应用非常广泛.某研究小组用粗铜(含杂质铁)制备氯化铜晶体(CuCl2•2H2O)的流程如下:

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的bd(填代号).
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)检验溶液Ⅰ中的存在Fe3+实验操作是取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因H2S+Cu2+=CuS↓+2H+;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉;
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%(用含m,c,V的代数式表示,不用化简).
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.

已知常温下,Cu2+、Fe3+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| 金属离子 | Fe3+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 6.7 |
(1)溶液Ⅰ中加入试剂X可以调节溶液pH,从而除去Fe3+且不引人杂质
①试剂X选用下列物质中的bd(填代号).
a.NaOH b.CuO c.Cu d.Cu(OH)2
②调节溶液pH时,理论上可选择pH最大范围是3.2≤pH<4.7.
(2)检验溶液Ⅰ中的存在Fe3+实验操作是取少量溶液I于试管中,滴加KSCN溶液,若溶液变红色,证明溶液里有Fe3+.
(3)向溶液Ⅱ中通入H2S气体,溶液变浑浊,pH减小,用离子方程式解释其原因H2S+Cu2+=CuS↓+2H+;
(4)某学习小组用碘量法测定CuCl2•2H2O样品的纯度(杂质不参与反应),实验如下:
a.准确称取CuCl2•2H2O样品mg于小烧杯中,加入适量蒸馏水和足量的碘化钾,再滴入适量的稀硫酸,充分反应后,将所得混合液配成250mL待测溶液.(已知:2Cu2++4I-═2Cu↓+I2)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol•L-1Na2S2O3标准液滴定至终点,重复2次,测得消耗标准液体积的平均值为VmL.(已知:I2+2S2O32-═2I-+S4O62-)
①实验中使用的指示剂名称为淀粉;
②达到滴定终点时,仰视滴定管读数将使测定结果偏高(填“偏高”“偏低”或“无影响”)
③该样品中的质量分数为$\frac{cV×1{0}^{-3}mol×10×171g/mol}{mg}$×100%(用含m,c,V的代数式表示,不用化简).
(5)在空气中由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.