题目内容
15.把10.2g镁铝混合物的粉末放入400mL盐酸中恰好完全反应,得到11.2LH2(标准状况下).试计算:(1)该混合物中镁的质量分数
(2)盐酸的物质的量浓度.
分析 发生反应:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,设Mg、Al的物质的量分别为xmol、ymol,根据方程式表示出消耗HCl、生成氢气的物质的量,根据二者质量与生成氢气的体积列方程计算Mg、Al的物质的量.
(1)根据m=nM计算Mg的质量,进而计算Mg的质量分数;
(2)根据n=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:标况下11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
设10.2g镁铝合金中含有镁xmol,含有铝ymol,则:
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y $\frac{3}{2}$y
由题意得:$\left\{\begin{array}{l}{24x+27y=10.2}\\{x+\frac{3}{2}y=0.5}\end{array}\right.$
解得:x=y=0.2,
(1)Mg的质量=0.,2mol×24g/mol=4.8g,故混合物中Mg的质量分数=$\frac{4.8g}{10.2g}$×100%=47.1%,
答:混合物中Mg的质量分数为47.1%;
(2)反应消耗的盐酸的总物质的量为:0.2mol×2+0.2mol×3=1mol,
盐酸的物质的量浓度为:c(HCl)=$\frac{1mol}{0.4L}$=2.5mol/L,
答:该盐酸的物质的量浓度为2.5mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是接触室,现代氯碱工业的装置名称是离子交换膜电解槽;
(2)写出生产过程中XFe YHCl (填化学式)
(3)写出产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4
(4)生产中为了提髙CuCl产品的质量,采用抽滤或者减压过滤_法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少产品CuCl的损失,生产过程中调节溶液的pH不能过大的原因是防止CuCl水解.
(5)在CuCl的生成过程中理论上不需要补充S02气体,其理由是Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1﹕1,所以理论上不需要补充SO2气体
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放人玻璃珠50粒和10mL过量的FeCl3溶液 250mL锥形瓶中,不断摇动;
②待样品溶解后加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+如此再重复二次测得
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 24.65 | 24.75 | 24.70 |
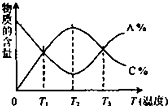 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
| A. | 乙烯的最简式:CH2=CH2; 对甲基苯甲醇的结构简式: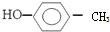 | |
| B. | Cl-的结构示意图: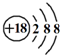 甲烷分子的球棍模型: 甲烷分子的球棍模型: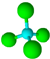 | |
| C. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ | |
| D. | 羟基的电子式: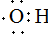 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl |
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
| A. | 锌粒与醋酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | 铁粉与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
