题目内容
已知A是由两种阳离子和一种阴离子组成的盐.C在空气中迅速变为灰绿色,最后变成红褐色.试根据下列转化关系回答有关问题:
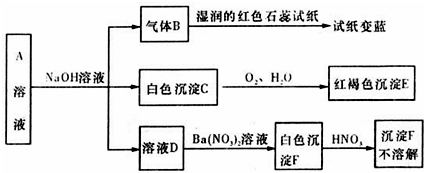
(1)试判断:B为 ,F为 ;
(2)写出C→E的化学反应方程式 ;
(3)根据上述关系写出盐A的化学式 .

(1)试判断:B为
(2)写出C→E的化学反应方程式
(3)根据上述关系写出盐A的化学式
考点:无机物的推断
专题:推断题
分析:C在空气中迅速变为灰绿色,最后变成红褐色E,可推知C为Fe(OH)2、E为Fe(OH)3,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A是由两种阳离子和一种阴离子组成的盐,与碱反应得到D,D与硝酸钡反应得到白色沉淀,该白色沉淀不溶于硝酸,可推知A含有SO42-,不可能含有SO32-,与亚铁离子不能共存,故F为BaSO4,A为(NH4)2Fe(SO4)2,据此解答.
解答:
解:C在空气中迅速变为灰绿色,最后变成红褐色E,可推知C为Fe(OH)2、E为Fe(OH)3,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A是由两种阳离子和一种阴离子组成的盐,与碱反应得到D,D与硝酸钡反应得到白色沉淀,该白色沉淀不溶于硝酸,可推知A含有SO42-,不可能含有SO32-,与亚铁离子不能共存,故F为BaSO4,A为(NH4)2Fe(SO4)2,
(1)由上述分析可知,B为NH3,F为BaSO4,故答案为:NH3;BaSO4;
(2)C→E的化学反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)2,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)2;
(3)由上述分析可知,盐A的化学式为:(NH4)2Fe(SO4)2,
故答案为:(NH4)2Fe(SO4)2.
(1)由上述分析可知,B为NH3,F为BaSO4,故答案为:NH3;BaSO4;
(2)C→E的化学反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)2,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)2;
(3)由上述分析可知,盐A的化学式为:(NH4)2Fe(SO4)2,
故答案为:(NH4)2Fe(SO4)2.
点评:本题考查无机物推断,物质的颜色及特殊性质是推断的突破口,注意确定A中不可能含有亚硫酸根,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列措施不符合“绿色化学”思想的是( )
| A、循环使用物料 |
| B、用水代替有机溶剂 |
| C、直接排放电镀废水 |
| D、发展原子利用率达到100%的化学反应 |
下列反应的离子方程式书写正确的是( )
| A、碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氯化铝溶液与氨水反应:Al3++4OH-=AlO2-+2H2O |
| D、氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
X、Y、Z是周期表中相邻的三种短周期元素,它们原子半径依次减小,X与Z的核电荷数之比为3:4,X、Y、Z分别与氢元素形成氢化物.下列叙述正确的是( )
| A、Z是第二周期ⅣA族元素 |
| B、最高价氧化物对应的水化物的酸性:Y<X |
| C、非金属性:X<Y<Z |
| D、X、Y、Z的氢化物稳定性逐渐减弱 |


 ,该离子的符号为
,该离子的符号为 所示,写出它的化学式
所示,写出它的化学式