题目内容
实验室常用的浓盐酸密度为1.17g?mL-1,质量分数为36.5%.
(1)此浓盐酸的物质的量浓度为 .
(2)取此浓盐酸50mL,用蒸馏水稀释到200mL,稀释后盐酸的物质的量浓度为 .
(3)将13g锌投入足量的上述实验所得的稀盐酸中,充分反应后,放出的H2在标准状况下的体积为 .
(1)此浓盐酸的物质的量浓度为
(2)取此浓盐酸50mL,用蒸馏水稀释到200mL,稀释后盐酸的物质的量浓度为
(3)将13g锌投入足量的上述实验所得的稀盐酸中,充分反应后,放出的H2在标准状况下的体积为
考点:物质的量浓度的相关计算
专题:
分析:(1)根据c
计算;
(2)根据稀释定律,稀释前后HCl的不变,据此计算;
(3)盐酸足量,Zn完全反应,根据n=
计算Zn的物质的量,根据电子转移守恒计算氢气物质的量,再根据V=nVm计算氢气体积.
| 1000ρω |
| M |
(2)根据稀释定律,稀释前后HCl的不变,据此计算;
(3)盐酸足量,Zn完全反应,根据n=
| m |
| M |
解答:
解:(1)根据c
可知,密度为1.17g?mL-1,质量分数为36.5%的浓盐酸的物质的量浓度为
mol/L=11.7mol/L,
故答案为:11.7mol/L;
(2)根据稀释定律,稀释前后HCl的不变,稀释后盐酸的物质的量浓度为
=2.925mol/L,故答案为:2.925mol/L;
(3)盐酸足量,Zn完全反应,13g Zn的物质的量为
=0.2mol,根据电子转移守恒,生成氢气物质的量为
=0.2mol,标况下生成氢气的体积为0.2mol×22.4L/mol=4.48L,故答案为:4.48L.
| 1000ρω |
| M |
| 1000×1.17×36.5% |
| 36.5 |
故答案为:11.7mol/L;
(2)根据稀释定律,稀释前后HCl的不变,稀释后盐酸的物质的量浓度为
| 0.05L×11.7mol/L |
| 0.2L |
(3)盐酸足量,Zn完全反应,13g Zn的物质的量为
| 13g |
| 65g/mol |
| 0.2mol×2 |
| 2 |
点评:本题考查物质的量浓度计算、化学方程式计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
心酮胺是治疗冠心病的药物.它具有如下结构简式:下列关于心酮胺的描述,错误的是( )
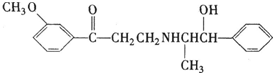
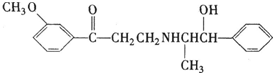
| A、可以在催化剂作用下和溴反应 |
| B、可以在碱性条件下发生水解反应 |
| C、能够使酸性高锰酸钾溶液褪色 |
| D、可以和浓硫酸与浓硝酸的混合液反应 |
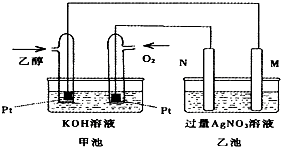 如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )
如图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极.工作时M、N两个电极的质量都不减少,则下列说法正确的是( )| A、M电极的材料是石墨 |
| B、若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C、在此过程中,甲池中OH-向通乙醇的一极移动 |
| D、在此过程中,乙池溶液中电子从M电极向N电极移动 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C、“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 |
| D、电解MgCl2溶液,可制得金属镁 |
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是( )
| A、变质的油脂有难闻的气味,是由于油脂发生了水解反应 |
| B、为了防止食品受潮及氧化变质,常在包装袋中加入无水硫酸铜和还原铁粉 |
| C、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| D、在流感多发场所可使用乙醇、过氧化氢、次氯酸钠等消毒液进行消毒,消毒液均可以将病毒氧化而达到消毒的目的 |
下列各组物质中,全部是由极性共价键结合成的极性分子的是( )
| A、H2、HCl、Na2S |
| B、Na2O2、CH4、SiH4 |
| C、CS2、CCl4、N2 |
| D、HCl、H2O、NH3 |
