题目内容
下列各组物质中,全部是由极性共价键结合成的极性分子的是( )
| A、H2、HCl、Na2S |
| B、Na2O2、CH4、SiH4 |
| C、CS2、CCl4、N2 |
| D、HCl、H2O、NH3 |
考点:极性键和非极性键,极性分子和非极性分子
专题:化学键与晶体结构
分析:不同非金属元素之间形成的化学键为极性共价键,同种元素之间形成的共价键为非极性键;
极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子;据此判断.
极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子;据此判断.
解答:
解:A.H2是由非极性键结合成的非极性分子,HCl是有极性键结合成的极性分子,Na2S属于离子化合物,不含共价键,故A错误;
B.Na2O2是离子化合物,CH4是由C-H极性共价键结合成的非极性分子,SiH4是Si-H极性共价键结合成的非极性分子,故B错误;
C.CS2是由C=S极性共价键结合成的非极性分子,CCl4是由C-Cl极性共价键结合成的非极性分子,N2是N≡N非极性共价键结合成的非极性分子,故C错误;
D.HCl是由H-Cl极性共价键结合成的极性分子,H2O是由H-O极性共价键结合成的极性分子,NH3是由N-H极性共价键结合成的极性分子,故D正确;
故选:D.
B.Na2O2是离子化合物,CH4是由C-H极性共价键结合成的非极性分子,SiH4是Si-H极性共价键结合成的非极性分子,故B错误;
C.CS2是由C=S极性共价键结合成的非极性分子,CCl4是由C-Cl极性共价键结合成的非极性分子,N2是N≡N非极性共价键结合成的非极性分子,故C错误;
D.HCl是由H-Cl极性共价键结合成的极性分子,H2O是由H-O极性共价键结合成的极性分子,NH3是由N-H极性共价键结合成的极性分子,故D正确;
故选:D.
点评:本题考查极性键和非极性键,极性分子和非极性分子,熟悉常见元素之间的成键是解答本题的关键,注意明确化学键与分子的极性的关系来分析解答即可,难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
下列化学用语书写正确的是( )
A、甲烷的电子式: |
B、丙烯的键线式: |
C、乙醚的结构式: |
| D、乙烯的结构简式:CH2CH2 |
进行化学实验必须注意安全,下列说法不正确的是( )
| A、点燃氢气前要检验氢气的纯度,以免发生爆炸 |
| B、不慎将浓盐酸沾到皮肤上,要立即用浓碱溶液冲洗 |
| C、CO气体有毒,处理CO尾气时可将其点燃,转化为无毒的CO2 |
| D、如果少量酒精失火燃烧,可用湿抹布盖灭火焰 |
用NA表示阿伏加德罗常数的值.下列判断错误的是( )
| A、NA个H+的质量为1 g |
| B、2 L 0.5mol/L Na2SO4溶液中含2NA个Na+ |
| C、32 g O2中含有2NA个O原子 |
| D、相同质量的CO和N2,其体积比一定为1:1 |
固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、AgNO3中的一种或几种组成,某同学对该固体进行了如图实验:
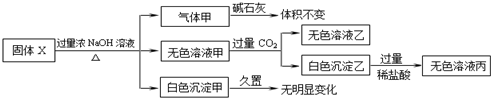
下列判断正确的是( )

下列判断正确的是( )
| A、气体甲一定是纯净物 |
| B、白色沉淀甲可能是混合物 |
| C、固体X中一定存在AlCl3、(NH4)2SO4、MgCl2 |
| D、固体X中一定不存在FeCl2、AgNO3 |
