题目内容
5.下列溶液中微粒的物质的量浓度关系不正确的是( )| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
分析 A.氯元素守恒分析微粒守恒关系;
B.碳酸钠溶液中存在质子守恒,水电离出所有氢离子浓度等于其电离出的所有氢氧根离子浓度;
C.物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中存在物料守恒,n(Cl)=n(C);
D.向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性.
解答 解:A.将0.1molCl2全部溶于水形成的1L溶液中氯元素物质的量浓度总和为0.2mol/L,2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 ,故A正确;
B.Na2CO3溶液中存在质子守恒:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B错误;
C.物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中存在物料守恒:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故C正确;
D.向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,再滴加少许NaOH呈中性,c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故D正确;
故选B.
点评 本题考查了溶液中物料守恒分析、离子浓度大小比较、注意元素的所有存在形式的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
15.下列实验可达到实验目的是( )
①将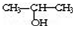 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2
②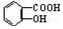 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备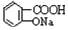
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
①将
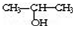 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2②
 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备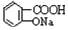
③用浓溴水除去苯中混有的苯酚
④用溴水即可检验CH2=CH-CHO中的碳碳双键.
| A. | 只有③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
16.填写下列表格:
| 原子组成 | Z | N | A |
| 3919K | 19 | 20 | 39 |
| 168O | 8 | 8 | 16 |
| 4018Ar | 18 | 22 | 40 |
13.下列说法不正确的是( )
| A. | 实验室应将钠保存在煤油中 | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 可用酒精代替CCl4萃取碘水中的碘单质 | |
| D. | 金属镁失火不可用水来灭火 |
20.下列说法正确的是( )
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
9.与实际化工生产流程相符的叙述是( )
| A. | 让Cl2和H2混合后,点燃生成氯化氢气体,再将氯化氢气体通入水中获得盐酸 | |
| B. | 制备硫酸,用水吸收三氧化硫气体生成浓硫酸 | |
| C. | 侯氏制碱法,将二氧化碳通入含氨的氯化钠饱和溶液中,过滤得到碳酸氢钠晶体 | |
| D. | 用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
6.下列有机物中,属于烃的衍生物且含有两种官能团的是( )
| A. | CH3Cl | B. | CH3CH2OH | C. | CH2═CHBr | D. | CH2=CH2 |
7.下列四种物质中,在一定条件下能与其它三种物质发生反应的是( )
| A. | CuSO4 | B. | CO2 | C. | NaOH | D. | H2SO4 |
 如图是某次实验探究铁及其化合物性质的流程图:
如图是某次实验探究铁及其化合物性质的流程图: