题目内容
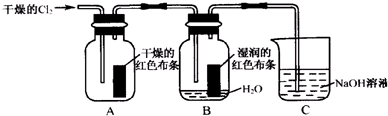
9.与实际化工生产流程相符的叙述是( )| A. | 让Cl2和H2混合后,点燃生成氯化氢气体,再将氯化氢气体通入水中获得盐酸 | |
| B. | 制备硫酸,用水吸收三氧化硫气体生成浓硫酸 | |
| C. | 侯氏制碱法,将二氧化碳通入含氨的氯化钠饱和溶液中,过滤得到碳酸氢钠晶体 | |
| D. | 用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
分析 A.混合点燃易发生爆炸;
B.应用浓硫酸吸收;
C.氨气易溶于水,应将二氧化碳通入含氨的氯化钠饱和溶液中,可生成碳酸氢钠;
D.氯化铝为共价化合物.
解答 解:A.应将氢气在氯气中燃烧生成氯化氢,故A错误;
B.制备硫酸时应避免形成酸雾,应用浓硫酸吸收,故B错误;
C.氨气易溶于水,应将二氧化碳通入含氨的氯化钠饱和溶液中,可生成碳酸氢钠,碳酸氢钠溶解度较小,可得到固体,故C正确;
D.氯化铝为共价化合物,熔融的氯化铝不导电,应用氧化铝,故D错误.
故选C.
点评 本题综合考查物质的工业制备,为高频考点,侧重考查化学与生活、生产的知识,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
相关题目
8.仪器名称为“量筒”的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
14.恒温、恒压下,在一个容积可变的容器中发生如下反应:N2+3H2?2NH3
(1)若开始时放入1mol N2和3mol H2,达到平衡后,生成a mol NH3
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为( )
(1)若开始时放入1mol N2和3mol H2,达到平衡后,生成a mol NH3
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为( )
| A. | 1mol和9mol | B. | 2mol和9mol | C. | 3mol和9mol | D. | 3mol和6mol |
1.Na2FeO4(Fe为+6价)是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,(已知Na2O2中O为-1价)对此反应下列说法中正确的是( )
| A. | Na2O2只作氧化剂,O2是还原产物 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 由上述方程式可知氧化性:Na2FeO4>Na2O2>O2 | |
| D. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
18.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
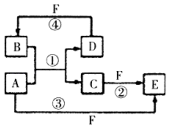 (1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题:
(1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题: ;
; ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.