题目内容
7.下列四种物质中,在一定条件下能与其它三种物质发生反应的是( )| A. | CuSO4 | B. | CO2 | C. | NaOH | D. | H2SO4 |
分析 题中涉及物质有CuSO4、CO2、NaOH、H2SO4等,只有氢氧化钠可与其它三种物质反应,可生成沉淀、水等,以此解答该题.
解答 解:A.硫酸铜与只与氢氧化钠反应,故A不选;
B.二氧化碳只与氢氧化钠反应,故B不选,
C.氢氧化钠可与CuSO4、CO2、H2SO4反应生成氢氧化铜沉淀、碳酸钠、硫酸钠,故C选;
D.硫酸只与氢氧化钠反应,故D不选.
故选C.
点评 本题考查元素化合物知识,为高频考点,侧重考查学生的双基,有利于培养学生良好科学素养,注意把握常见物质的性质,难度不大.

练习册系列答案
相关题目
5.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 将0.1molCl2全部溶于水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=0.2mol•L-1 | |
| B. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | 物质的量浓度均为0.1mol•L-1的NaClO与NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 室温下,向0.01mol•L-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
18.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO42-、NO3- | |
| B. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
2.下列叙述正确的是( )
| A. | 铝制容器可盛装热的浓硫酸 | |
| B. | 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 用氢氧化钠溶液吸收二氧化氮时有一氧化氮生成 |
12.设 NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在反应 KClO3+6HCl═KCl+3Cl2↑+3H2O 中,Cl2既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA | |
| B. | 标准状况下,22.4 L 甲苯中含有的 C-H 键数目为 8NA | |
| C. | 50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA | |
| D. | t℃时,MgCO3的 Ksp=4×10-6,则该温度下饱和 MgCO3溶液中含有的 Mg2+数目为 2×10-3 NA |
16.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 从100mL 10mol•L-1的浓盐酸中取出10mL | |
| D. | 20g NaOH溶解在水中配成500mL溶液 |
17. 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
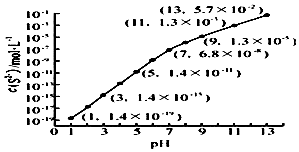
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.1已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
 研究硫元素及其化合物的性质具有重要意义.
研究硫元素及其化合物的性质具有重要意义.(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(3)25℃,两种酸的电离平衡常数如表.
足量NaHSO3溶液与NaHCO3溶液反应的离子方程式为2HSO3-+CO32-=2SO32-+CO2↑+H2O.
