题目内容
10.下列各物质中含氮原子数最少的是( )| A. | 0.1mol NH4Cl | B. | 0.1 mol N2 | ||
| C. | 1.204×1022个CO(NH2)2 | D. | 0.2mol NH3•H2O |
分析 根据N=$\frac{N}{{N}_{A}}$计算CO(NH2)2的物质的量,根据化学式计算N原子物质的量进行判断.
解答 解:A.0.1mol NH4Cl含有N原子物质的量为0.1mol×1=0.1mol;
B.0.1 mol N2含有N原子物质的量为0.1mol×2=0.2mol;
C.1.204×1022个CO(NH2)2的物质的量为$\frac{1.204×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.02mol,含有N原子物质的量为0.02mol×2=0.04mol;
T.0.2mol NH3•H2O含有N原子物质的量为0.1mol×1=0.2mol,
故选:C.
点评 本题考查物质的量有关计算,涉及微粒数目计算,比较基础,注意对化学式意义的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.某化学研究小组在使用FeSO4溶液与NaOH溶液制备Fe(OH)2沉淀过程中观察到生成的白色沉淀迅速转变为灰绿色,最后变为红褐色,该小组针对绿色物质展开研究.
[查阅文献]
(1)写出Fe(OH)2在空气中被氧化为Fe(OH)3的化学方程式6Fe(OH)2+O2+2H2O═2Fe3(OH)8;
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
(1)实验室保存FeSO4溶液常需加入Fe、H2SO4(填化学式,下同),为检验某FeSO4溶液是否变质,可向溶液中加入KSCN溶液或NaOH;
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
[查阅文献]
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
1.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
18.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液中:[Na+]+[H+]═[HCO3-]+2[CO32-]+[OH-] | |
| B. | 0.1 mol•L-1Na2S溶液中:2[Na+]═[S2-]+[HS-]+[H2S] | |
| C. | 0.1 mol•L-1 NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-] | |
| D. | 等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:[Na+]=[CH3COO-]>[H+]=[OH-] |
5. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 原子半径:rW>rZ>rY>rX | |
| B. | 含Y元素的硫酸盐溶液可以和强酸、强碱反应 | |
| C. | 最简单气态氢化物的热稳定性:Z>W | |
| D. | X的氢化物与X的最高价氧化物对应的水化物能形成离子化合物 |
6.实验室测定酸碱反应的反应热时,不需要用到的玻璃仪器是( )
| A. | 试管 | B. | 温度计 | C. | 烧杯 | D. | 环型玻璃搅拌棒 |
3.某药物中间体的合成路线如下.下列说法正确的是( )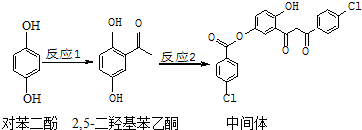

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1mol该中间体最多可与11 molH2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、取代、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
4.能正确表示下列反应的离子方程式是( )
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |