题目内容
10.下列有关实验操作、现象及结论描述正确的是( )| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中一定含有钾元素, 可能含钠元素 |
| B | 向某无色溶液中通入过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度大于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K的焰色反应为紫色,透过蓝色的钴玻璃观察;
B.通入过量的CO2气体,有白色沉淀产生,沉淀可能为硅酸,也可能为氢氧化铝;
C.品红溶液褪色,气体与品红化合生成无色物质,或气体溶于水具有强氧化性;
D.NaOH溶液过量,可与氯化镁、氯化铁均反应.
解答 解:A.K的焰色反应为紫色,透过蓝色的钴玻璃观察,不能确定是否含钠元素,则待测试液中一定含有钾元素,可能含钠元素,故A正确;
B.通入过量的CO2气体,有白色沉淀产生,沉淀可能为硅酸,也可能为氢氧化铝,则原溶液中可能含SiO32-,或AlO2-,故B错误;
C.品红溶液褪色,气体与品红化合生成无色物质,或气体溶于水具有强氧化性,则气体为SO2,或Cl2等,故C错误;
D.NaOH溶液过量,可与氯化镁、氯化铁均反应,发生沉淀的生成,而不是转化,则不能比较Fe(OH)3、Mg(OH)2的溶解度大小,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及焰色反应、离子检验、物质的性质、沉淀的生成及转化等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
20.某烃的结构简式为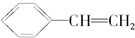 ,它可能具有的性质是( )
,它可能具有的性质是( )
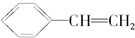 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 它能使溴水褪色,但不能使KMnO4酸性溶液褪色 | |
| B. | 它既能使溴褪色,也能使KMnO4酸性溶液褪色 | |
| C. | 它能发生加聚反应,生成物可用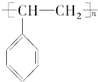 表示 表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
18.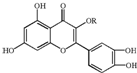 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物最多可与7mol Br2完全反应 | |
| D. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol |
2.下列说法正确的是( )
| A. | 某物质不属电解质,就属于非电解质 | |
| B. | SO3溶于水可导电,SO3属于电解质 | |
| C. | 能导电的物质属于电解质,NaCl属于电解质,NaCl晶体可导电 | |
| D. | 已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离 |
8.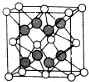 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:
(1)元素Y基态原子的核外电子排布式为1s22s22p63s23p64s2(或[Ar]4s2).
(2)42gT的单质分子中π键的个数为3NA;在T的最简单氢化物分子中T原子的杂化类型是sp3.研究者预想合成一个纯粹由T元素组成的新物种T5+T3-,若T5+离子中每个氮原子均满足8电子且呈对称结构,以下有关T5+推测正确的是BD(填序号)
A.N5+有24个电子
B.N5+阳离子中存在两个氮氮三键
C.N5+离子中存在三对未成键的电子对
D.N3-离子的空间构型为直线型
(3)TX3是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.它可在Z单质的催化作用下由X2和过量的TH3反应得到,试写出该反应的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.在该反应方程式中的几种物质所属的晶体类型有acd(填序号).
a.离子晶体 b.原子晶体 c.分子晶体 d.金属晶体
(4)T、W、X 3种元素的电负性由大到小的顺序为F>O>N(用元素符号表示).
(5)Z2+能与T的氢化物写出配位数为4的配离子[Z(TH3)4]2+,该配离子具有对称的空间构型,且离子中的两个TH3被两个Cl取代只能得到一种产物,则[Z(TH3)4]2+的空间构型为正四面体.
(6)X和Y形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,则晶胞边长a=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm.(用ρ、NA的计算式表示).
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| T | 基态原子2p能级有3个单电子 |
| W | 基态原子p轨道上成对电子数等于未成对电子数 |
| X | 氢化物常用于刻蚀玻璃 |
| Y | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| Z | 原子序数等于X与Y的原子序数之和 |
(2)42gT的单质分子中π键的个数为3NA;在T的最简单氢化物分子中T原子的杂化类型是sp3.研究者预想合成一个纯粹由T元素组成的新物种T5+T3-,若T5+离子中每个氮原子均满足8电子且呈对称结构,以下有关T5+推测正确的是BD(填序号)
A.N5+有24个电子
B.N5+阳离子中存在两个氮氮三键
C.N5+离子中存在三对未成键的电子对
D.N3-离子的空间构型为直线型
(3)TX3是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.它可在Z单质的催化作用下由X2和过量的TH3反应得到,试写出该反应的化学方程式:4NH3+3F2$\frac{\underline{\;Cu\;}}{\;}$NF3+3NH4F.在该反应方程式中的几种物质所属的晶体类型有acd(填序号).
a.离子晶体 b.原子晶体 c.分子晶体 d.金属晶体
(4)T、W、X 3种元素的电负性由大到小的顺序为F>O>N(用元素符号表示).
(5)Z2+能与T的氢化物写出配位数为4的配离子[Z(TH3)4]2+,该配离子具有对称的空间构型,且离子中的两个TH3被两个Cl取代只能得到一种产物,则[Z(TH3)4]2+的空间构型为正四面体.
(6)X和Y形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,则晶胞边长a=$\root{3}{\frac{312ρ}{{N}_{A}}}$cm.(用ρ、NA的计算式表示).
9.下列有关说法正确的是( )
| A. | 常温下,0.1 mol•L-1Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 常温下,0.1 mol•L-1HA溶液与0.1 mol•L-1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+) c(CH3COO-)c(CH3COOH) | |
| C. | 常温下,向0.1 mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的10倍 | |
| D. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol•L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) |
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)