题目内容
15.下表是元素周期表的一部分,针对表中的①~=⑩中元素,用规范的化学语言回答以下问题:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)①⑥⑦三元素的最高价氧化物对应的水化物的酸性强弱关系为:HClO4>HNO3>H2SiO3(用化学式表示);
(3)在③~⑦元素中,原子半径最大的是Na(用元素符号表示),②、③简单离子的半径大小关系是F->Na+(用离子符号表示);
(4)能说明⑦与⑩的非金属性强弱的事实依据的是:Cl2+2KBr=2KCl+Br2(用化学方程式说明).
分析 由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;氯原子核外有17个电子,各层电子数为2、8、7;
(2)最高价含氧酸最强的为高氯酸,非金属性越强最高价含氧酸的酸性越强;
(3)同周期自左而右原子半径减小;②、③简单离子的电子层结构相同,核电荷数越大离子半径越小;
(4)利用单质之间相互置换反应可以证明.
解答 解:由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
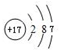
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,K的金属性最强,故还原性最强的元素是钾,最活泼的非金属元素是F,⑦为Cl,氯原子核外有17个电子,各层电子数为2、8、7,原子结构示意图为 ,
,
故答案为:钾;F; ;
;
(2)最高价含氧酸最强的为高氯酸,非金属性越强最高价含氧酸的酸性越强,故酸性:HClO4>HNO3>H2SiO3,
故答案为:HClO4>HNO3>H2SiO3;
(3)同周期自左而右原子半径减小,在③~⑦元素中,原子半径最大的是Na,②、③简单离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:F->Na+,
故答案为:Na;F->Na+;
(4)能说明⑦与⑩的非金属性强弱的事实依据的是:Cl2+2KBr=2KCl+Br2,
故答案为:Cl2+2KBr=2KCl+Br2.
点评 本题考查元素周期表与元素周期律,关键是掌握:1~20号元素的名称及符号,元素周期表的结构,能根据元素周期表中元素性质的递变规律进行分析判断,难度中等.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
1.下表中实验操作、现象以及所得出的结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
6.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
3.A元素最高正价和负价绝对值之差为6,B元素次外层有8个电子,BA2在水溶液中能电离出相同电子层结构的离子,则BA2是( )
| A. | CaCl2 | B. | CaF2 | C. | NO2 | D. | CO2 |
10.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 1.6gNH2-离子所含质子数为NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 9g D216O所含的中子数为4.5 NA |
20.某烃的结构简示为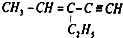 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
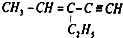 ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 3,3,6 | B. | 2,3,5 | C. | 2,5,4 | D. | 4,6,4 |
5.下列方法正确的是( )
①用过滤的方法除去食盐水中的泥沙
②用蒸馏的方法将自来水制成蒸馏水
③用酒精萃取碘水中的碘
④用淘洗的方法从沙里淘金.
①用过滤的方法除去食盐水中的泥沙
②用蒸馏的方法将自来水制成蒸馏水
③用酒精萃取碘水中的碘
④用淘洗的方法从沙里淘金.
| A. | ②③④ | B. | ①②④ | C. | ①③④ | D. | ①②③ |
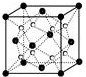 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.