题目内容
7. (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.①基态Fe3+的M层电子排布式为3s23p63d5.
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5. Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体 (填晶体类型);
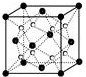
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为立方体.已知该晶胞的密度为ρ g/cm 3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{248}{ρ{N}_{A}}}$cm. (用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是BC.
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为sp,1mol Y2X2含有σ键的数目为3NA.
②化合物ZX3的沸点比化合物YX4的高,其主要原因是氨气之间形成氢键.
③元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是N2O.
分析 (1)①Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+;
②Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,进而计算x的值;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体;
(2)O和Na形成的一种只含有离子键的离子化合物为Na2O,该晶胞结构中黑球有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白球在内部,共有8个,所以黑球为O2-,白色球为Na+.计算晶胞质量,再根据m=ρV=ρa3计算;
(3)A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
B.同周期自左而右电负性增大;
C.离子电荷越大、半径越小,晶格能越大,晶体的熔点越高;
D.二氧化硫为V形结构;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高;
(4)原子序数小于36的X、Y、Z、W四种元素,Y原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为碳元素;形成化合物种类最多的元素为C、H元素,则X为碳元素;Z原子基态时2p原子轨道上有3个未成对电子,则Z原子核外电子排布为1s22s22p6,则Z为N元素;W的原子序数为29,则W为Cu元素.
解答 解:(1)①Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+离子核外电子排布式为1s22s22p63s23p63d5,其M层电子排布式为3s23p63d5,
故答案为:3s23p63d5;
②Fe原子最外层电子数为8,CO为配体,CO分子提供1对电子,则8+2x=18,故x=5;
Fe(CO)x常温下呈液态,熔沸点低,易溶于非极性溶剂,可判断Fe(CO)x晶体属于分子晶体,
故答案为:5;分子晶体;
(2)O和Na形成的一种只含有离子键的离子化合物为Na2O,该晶胞结构中黑球有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,白球在内部,共有8个,所以黑球为O2-,白色球为Na+,以晶胞中上面心O2-离子为研究对象,距一个O2-周围最近的Na+离子有8个,位于晶胞中上层4个Na+及上面晶胞中的下层4个Na+,8个Na+离子形成立方体结构,
晶胞质量为4×$\frac{62}{{N}_{A}}$g,则4×$\frac{62}{{N}_{A}}$g=ρ g/cm 3×(a cm)3,解得a=$\root{3}{\frac{248}{ρ{N}_{A}}}$,
故答案为:立方体;$\root{3}{\frac{248}{ρ{N}_{A}}}$;
(3)A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S>Si,故A错误;
B.同周期随原子序数增大,元素的电负性增大,故电负性C<N<O<F,故B正确;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高,晶格能CaO比KCl高,所以KCl比CaO熔点低,故C正确;
D.二氧化硫与二氧化碳均为酸性氧化物,化学性质相似,二氧化碳分子为直线型结构,但二氧化硫为V形结构,属于极性分子,相似相溶,溶解性大于二氧化碳的,故D错误;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高,故E错误,
故选:BC;
(4)原子序数小于36的X、Y、Z、W四种元素,Y原子基态时最外层电子数是其内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故Y为碳元素;形成化合物种类最多的元素为C、H元素,则X为碳元素;Z原子基态时2p原子轨道上有3个未成对电子,则Z原子核外电子排布为1s22s22p6,则Z为N元素;W的原子序数为29,则W为Cu元素.
①C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,
故答案为:sp;3NA;
②氨气分子之间形成氢键,甲烷中不存在氢键,氢键的存在导致氨气的沸点升高,所以化合物NH3的沸点比化合物CH4的高,
故答案为:氨气之间形成氢键;
③元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,
故答案为:N2O.
点评 本题是对物质结构的考查,涉及核外电子排布、配合物、晶体类型与性质、元素周期律、杂化方式、晶胞计算、等电子体、氢键等,是对物质结构的综合考查,需要学生具备扎实的基础,难度中等.

| A. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′>Q | |
| B. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′<Q | |
| C. | 1mol SO2(g)的能量>1mol S(s)的能量+1mol O2(g)的能量 | |
| D. | 1mol SO2(g)的能量<1mol S(s)的能量+1mol O2(g)的能量 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入如表.
| 实验步骤 | 实验现象与结论 |
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)①⑥⑦三元素的最高价氧化物对应的水化物的酸性强弱关系为:HClO4>HNO3>H2SiO3(用化学式表示);
(3)在③~⑦元素中,原子半径最大的是Na(用元素符号表示),②、③简单离子的半径大小关系是F->Na+(用离子符号表示);
(4)能说明⑦与⑩的非金属性强弱的事实依据的是:Cl2+2KBr=2KCl+Br2(用化学方程式说明).
| A. | 氯化钠加热融化 | B. | 氢氧化钠溶于水 | ||
| C. | 氯化氢气体溶于水 | D. | 酒精溶于水 |
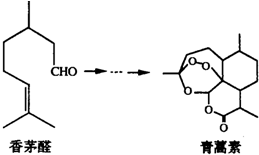
| A. | 青蒿素易溶于水,更易溶于乙醇等有机溶剂中 | |
| B. | 向香茅醛中滴加溴水后溴水褪色,证明香茅醛中含有碳碳双键 | |
| C. | 香茅醛与青蒿素均能发生氧化、取代、加成、聚合反应 | |
| D. | 香茅醛的同系物中,含4个碳原子的有机物有3种(不考虑立体异构) |
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | I在DB2中燃烧生成两种化合物 | |
| B. | A、H、J的离子半径由大到小顺序是H>J>A | |
| C. | G元素的单质不存在同素异形体 | |
| D. | A单质能从B的氢化物中置换出B单质来 |
| A. | Ag+、NH3 | B. | BF3、NH3 | C. | Co3+、H2O | D. | Ag+、H+ |