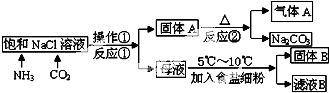
题目内容
对某次酸雨成分的分析数据如下表,此次酸雨的pH约为( )
| 离子 | NH4+ | Na+ | Cl- | NO3- | SO42- |
| 浓度(mol/L) | 2.0×10-5 | 1.9×10-5 | 6.0×10-5 | 2.3×10-5 | 2.8×10-5 |
| A、3 | B、4 | C、5 | D、6 |
考点:pH的简单计算
专题:
分析:根据溶液中电荷守恒计算酸雨中氢离子浓度,再根据pH的计算公式计算溶液的pH.
解答:
解:溶液中阴阳离子所带电荷总数相等,设氢离子浓度为C,则c (NH4+)+c (Na+)+C(H+)=c(Cl-)+c (NO3-)+2×c (SO42-),即2×10-5mol/L+1.9×10-5mol/L+C(H+)=6×10-5mol/L+2.3×10-5mol/L+2×2.8×10-5mol/L,解得C(H+)=10-4 mol/L,pH=4,故选B.
点评:本题考查了溶液的pH的简单计算,难度不大,明确溶液中阴阳离子所带电荷相等是解本题的关键,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
已知98%的浓硫酸的物质的量浓度为18.4mol/L,则49%的硫酸的物质的量浓度( )
| A、等于9.2 mo1/L |
| B、小于 9.2 mo1/L |
| C、大于 9.2 mo1/L |
| D、无法确定 |
用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A、标准状况下,1molH2O的体积约为22.4L |
| B、1L1mol/L的CaCl2溶液中含Cl-的数目为NA |
| C、在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA |
| D、标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
用NA表示阿伏加德罗常数的值.下列说法正确是( )
| A、标准状况下,2.24 L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、0.1mol Cl2与足量铁粉反应转移电子的数目为0.2NA |
| D、标准状况下,2.24L O2和1.12L NO混合后的气体分子总数为0.15×6.02×1023 |
欲使CH3COONa稀溶液中的
值增大,可采取的措施是( )
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
工业上生产下列物质,不涉及氧化还原反应的是( )
| A、用铝矾土(主要成分Al2O3)生产金属铝 |
| B、用硫铁矿(主要成分FeS2)生产硫酸 |
| C、用海水、贝壳生产氯化镁晶体 |
| D、用氯化钠生产烧碱 |
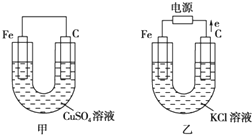 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后: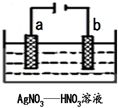 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.