题目内容
X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素.
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为 ;Y与氢原子按个数比1:2形成的含18个电子的化合物的电子式为 .
(2)X、E同主族,纯净的单质E可用于制太阳能电池,则X在周期表中的位置是 ;X与E作电极,同NaOH溶液可构成原电池,则该电池负极的电极反应式为: .
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,W的一种氧化物W2O是酸性氧化物,W2O与水反应的方程式为 ,W2O的结构式为 .
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的,D的单质与Z的最高价氧化物对应水化物反应的离子方程式为 .
(5)(XY)2与W2性质相似,则(XY)2分子中含有的化学键有 (填“离子键”、“极性键”或“非极性键”);(XY)2的制备原理同实验室制取W2类似,在酸性条件下用MnO2氧化对应的阴离子得到.写出制取(XY)2的离子方程式 .
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为
(2)X、E同主族,纯净的单质E可用于制太阳能电池,则X在周期表中的位置是
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,W的一种氧化物W2O是酸性氧化物,W2O与水反应的方程式为
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的,D的单质与Z的最高价氧化物对应水化物反应的离子方程式为
(5)(XY)2与W2性质相似,则(XY)2分子中含有的化学键有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素.
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,故Y为氮;
(2)X、E同主族,纯净的单质E可用于制太阳能电池,故E为硅,那么X为碳;
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,故W为氯;
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的,故D为铝,据此推断Z为钠;
(5)(CN)2与Cl2性质相似,据此解答即可.
(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,故Y为氮;
(2)X、E同主族,纯净的单质E可用于制太阳能电池,故E为硅,那么X为碳;
(3)常温常压下,W的单质为气体,且常用于自来水的消毒,故W为氯;
(4)Z、D、E、W同周期,D的简单离子半径是同周期简单离子中半径最小的,故D为铝,据此推断Z为钠;
(5)(CN)2与Cl2性质相似,据此解答即可.
解答:
解:依据分析可知X为碳,Y为氮,Z为钠,D为铝,E为硅,W为氯,
(1)N元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为 NH3+HNO3═NH4NO3;N与氢原子按个数比1:2形成的含18个电子的化合物为肼,肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为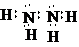 ,
,
故答案为:NH3+HNO3═NH4NO3;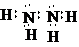 ;
;
(2)依据推断可知X为碳,在周期表中的位置是:第二周期第ⅣA族;C与Si作电极,Si能与NaOH溶液反应生成硅酸钠和氢气,则该电池负极的电极反应式为Si-4e-+6OH-═SiO32-+3H2O,故答案为:Si-4e-+6OH-═SiO32-+3H2O;
(3)Cl2O的性质类似与Cl2,Cl2与水反应生成盐酸和次氯酸,Cl2O中Cl均为+1价,故Cl2O与水反应只生成HClO,反应方程式为:Cl2O+H2O═2HClO,Cl2O的结构式为:Cl-O-Cl,故答案为:Cl2O+H2O═2HClO; Cl-O-Cl;
(4)铝与氢氧化钠反应生成偏铝酸钠与氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)(CN)2分子中存在C≡N极性键与C-C非极性键,实验室制取氯气原理为:二氧化锰与浓盐酸反应,(CN)2的制备原理同实验室制取Cl2类似,
故答案为:极性键,非极性键;MnO2+4H++2CN-═Mn2++(CN)2+2H2O.
(1)N元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化学方程式为 NH3+HNO3═NH4NO3;N与氢原子按个数比1:2形成的含18个电子的化合物为肼,肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为
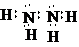 ,
,故答案为:NH3+HNO3═NH4NO3;
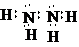 ;
; (2)依据推断可知X为碳,在周期表中的位置是:第二周期第ⅣA族;C与Si作电极,Si能与NaOH溶液反应生成硅酸钠和氢气,则该电池负极的电极反应式为Si-4e-+6OH-═SiO32-+3H2O,故答案为:Si-4e-+6OH-═SiO32-+3H2O;
(3)Cl2O的性质类似与Cl2,Cl2与水反应生成盐酸和次氯酸,Cl2O中Cl均为+1价,故Cl2O与水反应只生成HClO,反应方程式为:Cl2O+H2O═2HClO,Cl2O的结构式为:Cl-O-Cl,故答案为:Cl2O+H2O═2HClO; Cl-O-Cl;
(4)铝与氢氧化钠反应生成偏铝酸钠与氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)(CN)2分子中存在C≡N极性键与C-C非极性键,实验室制取氯气原理为:二氧化锰与浓盐酸反应,(CN)2的制备原理同实验室制取Cl2类似,
故答案为:极性键,非极性键;MnO2+4H++2CN-═Mn2++(CN)2+2H2O.
点评:本题主要考查的是元素的推断、电子式的书写、离子反应方程式的书写等,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有一可逆反应2A(g)+3B(g)?4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是( )
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |