题目内容
3.在1L溶液中溶有16.0g CuSO4和20g Fe2(SO4)3,向该溶液中加入9.75g Zn,充分反应后,溶液中含有的离子是( )| A. | Zn2+、Fe2+和Cu2+ | B. | Zn2+、Fe3+和Cu2+ | C. | Fe2+和Zn2+ | D. | Cu2+ 和Zn2+ |
分析 n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,n[Fe2(SO4)3]=$\frac{20g}{400g/mol}$=0.05mol,n(Zn)=$\frac{9.75g}{65g/mol}$=0.15mol,氧化性强弱顺序是Fe3+>Cu2+,根据转移电子守恒确定溶液中存在的离子,据此分析解答.
解答 解:n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,n[Fe2(SO4)3]=$\frac{20g}{400g/mol}$=0.05mol,n(Zn)=$\frac{9.75g}{65g/mol}$=0.15mol,氧化性强弱顺序是Fe3+>Cu2+,Zn完全反应转移电子物质的量=0.15mol×2=0.3mol,如果Fe3+完全反应,转移电子物质的量=2n[Fe2(SO4)3]×1=2×0.05mol×1=0.1mol,铜离子完全反应转移电子物质的量=0.1mol×2=0.2mol,Fe3+、Cu2+完全反应转移电子物质的量=(0.1+0.2)mol=0.3mol,所以Zn完全溶解,溶液中离子为Fe2+和Zn2+,
故选C.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,利用转移电子守恒确定溶液中参加反应的离子,明确离子反应先后顺序是解本题关键,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向NaAlO2溶液通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+2I-+8H+═3Fe2++I2+4H2O | |
| C. | 用FeS除去工业废水中的Hg2+:Hg2++S2-═HgS↓ | |
| D. | 向饱和的Ca(OH)2溶液中滴加过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
18.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)Z在元素周期表中位于ⅣA族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.
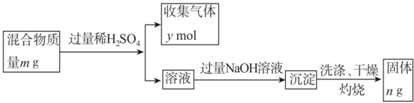
能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
8.下列关于化合物的式量(M)叙述不正确的是( )
| A. | 式量为30的碳、氢、氧组成的化合物无同分异构体 | |
| B. | 式量为128的烃的分子式不一定是C9H20 | |
| C. | 烃的式量可以是偶数,也可以是奇数 | |
| D. | 有机物分子中,H原子数可以是偶数,也可以是奇数 |
12.下列实际应用与水解知识无关的是( )
| A. | 处理锅炉水垢的CaSO4,可先用Na2CO3溶液处理,再用酸去除 | |
| B. | 向TiCl4中加入大量的水,同时加热,可以制备纳米材料制备TiO2 | |
| C. | AlCl3溶液蒸干灼烧得不到AlCl3,而用SOCl2与AlCl3•6H2O混合共热可得无水AlCl3 | |
| D. | 铵态氮肥不可与草木灰同时使用 |