题目内容
10.运用元素周期表和元素周期律,下列推断中不正确的是( )| A. | 砹(第ⅦA)是一种有色固体,它的气态氰化物很不稳定,砹化银为有色沉淀,且不溶解于稀硝酸,但是容易分解 | |
| B. | 在周期表中金属和非金属元素的分界线附件可以寻找制取新农药的元素 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | 溴化氢没有氯化氢稳定,其水溶液的酸性比较为:盐酸>氢溴酸 |
分析 A、根据卤素单质颜色、状态变化,推测砹是一种有色固体,元素的非金属性越弱,其氢化物越不稳定,根据AgCl、AgBr、AgI颜色及溶解性判断;
B、在周期表中金属和非金属元素的分界线附近可以寻找制取半导体的材料;
C、铷位于周期表第六周期第ⅠA族,金属性很强,对应的氢氧化物为强碱;
D、元素非金属性越强对应氢化物越稳定,其水溶液的酸性越弱.
解答 解:A、卤族元素性质具有相似性,自上而下颜色加深、物质熔点升高,元素非金属性减弱,氢化物稳定性减弱,AgCl、AgBr、AgI颜色依次加深均难溶于硝酸,稳定性减弱,可推知砹(At)为有色固体,HAt不稳定,AgAt是不溶于硝酸的有色固体,容易分解,故A正确;
B、在周期表中金属和非金属元素的分界线附近可以寻找制取半导体的材料,故B错误;
C、铷位于周期表第六周期第ⅠA族,金属性很强,对应的氢氧化物为强碱,碱金属元素对应的硫酸盐都易溶于水,故C正确;
D、溴元素的非金属性弱于氯元素,所以溴化氢没有氯化氢稳定,水溶液的酸性比较为:盐酸<氢溴酸,故D错误;
故选BD.
点评 本题考查元素周期表与周期律的综合应用,题目难度不大,本题注意周期表的结构和规律,注意相关基础知识的积累.

练习册系列答案
相关题目
20.比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推导不合理的是( )
| 序号 | 化学反应事实 | 影响化学反应因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气发生反应,而在高温时能与氧气反应 | 反应温度 |
| C | 水在通电的条件才能分解,双氧水只要加入二氧化锰就迅速分解 | 催化剂 |
| D | 铜片在空气中很难燃烧,纳米铜粉在空气中较易燃烧 | 反应物的接触面积 |
| A. | A | B. | B | C. | C | D. | D |
1.如图是关于反应aA2(g)+bB2(g)?cC(g)△H<0 的平衡移动图象,影响平衡移动的原因可能是( )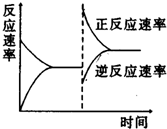

| A. | 升高温度,同时加压 | |
| B. | 降低温度,同时减压 | |
| C. | 增大反应物浓度,同时减小生成物浓度 | |
| D. | 增大反应物浓度,同时升高温度 |
18.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)Z在元素周期表中位于ⅣA族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.
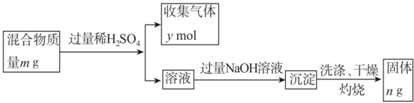
能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
5.某课外活动小组,收集了一种合金进行研究:
(1)外观暗灰色,表皮光滑.
(2)在酒精灯上灼烧,火焰绿色;合金片熔化,但不滴落.
(3)取刮去表皮的金属,放入足量稀硫酸中,收集到标准状况下氢气9.96 L.
(4)另取刮去表皮的金属,放入足量氢氧化钠溶液中,也收集到标准状况下氢气9.96 L.
试据此判断,合金中含有的成分是( )
(1)外观暗灰色,表皮光滑.
(2)在酒精灯上灼烧,火焰绿色;合金片熔化,但不滴落.
(3)取刮去表皮的金属,放入足量稀硫酸中,收集到标准状况下氢气9.96 L.
(4)另取刮去表皮的金属,放入足量氢氧化钠溶液中,也收集到标准状况下氢气9.96 L.
试据此判断,合金中含有的成分是( )
| A. | Cu、Fe | B. | K、Na | C. | Cu、Al | D. | Zn、Mg |
15.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1molNa与O2在一定条件下生成Na2O和Na2O2混合物时,失去电子数为0.2NA | |
| B. | 50mL 12mol•L-1浓盐酸与足量二氧化锰加热反应,生成Cl2的分子数为0.15NA | |
| C. | 常温下,100mL 1mol•L-1Na2CO3溶液中阴离子总数等于0.1NA | |
| D. | 标准状况下,6.72LCO2中所含的共用电子对数为1.2NA |
16.25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比①:②:③:④是( )
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 14:13:2:1 |