题目内容
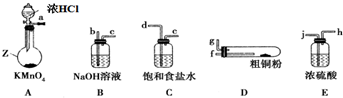
9.已知磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.磺酰氯(SO2Cl2)的制备方法及装置图如图1:SO2(g)+Cl2(g)?SO2C12(g)△H<0,
(1)化合物SO2Cl2中S元素的化合价是+6.
(2)仪器D的名称是三颈烧瓶,仪器C的作用除了吸收氯气和二氧化硫,还具有防止外界空气中的水蒸气进入三颈烧瓶作用.
(3)戊是贮气装置,则E中的溶液是饱和的亚硫酸氢钠溶液;若缺少装置乙和丁,则产物变质,发生反应的化学方程式是SO2Cl2+2H2O=2HCl+H2SO4
(4)反应结束后,将丙中混合物分离开的实验操作是蒸馏.
(5)有关该实验叙述正确的是b
a、X、Y最好的组合是铜片和浓硫酸
b、活性炭的作用是作催化剂
c、冷凝管B也可以用作蒸馏
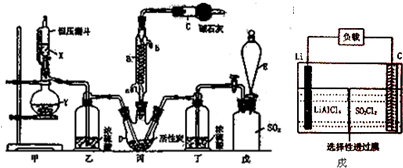
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图戌所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑,则电池工作时,正极的电极反应式为是SO2Cl2+2e-=2 Cl -+SO2↑.
分析 磺酰氯(SO2Cl2)的制备:SO2+Cl2?SO2C12,氯气和SO2在木炭作催化剂的作用下合成SO2C12,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,甲装置:浓盐酸和高锰酸钾固体制备氯气,乙装置:干燥氯气,丙装置:制备磺酰氯,同时防止外界空气中的水蒸气进入三颈烧瓶,丁装置:干燥装置,防止SO2Cl2的水解,戊装置:贮存二氧化硫气体,据此分析作答.
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,根据化合价规则计算S元素的化合价;
(2)结合常见的仪器,可命名仪器D;因SO2Cl2易水解,应防止水进入反应容器中;
(3)戊是储存SO2的装置,可以通过E中滴加的溶液排出SO2气体,因此此溶液不能溶解SO2;装置乙和丁的装置均为干燥装置,防止SO2Cl2的水解;
(4)相互混溶的液体混合物可以根据沸点差异进行分离;
(5)装置甲是制备Cl2的,催化剂可以改变反应速率,蒸馏操作应在蒸馏烧瓶中进行,冷凝管仅是冷却蒸汽的;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应.
解答 解:(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,令S元素化合价为x,根据化合价规则x+2×(-2)-1=0,故x=6,即S元素的化合价为+6,
故答案为:+6;
(2)仪器D是三颈瓶,C中碱石灰除吸收含有氯气和二氧化硫的尾气,还可以防止水进入三颈瓶中,避免SO2Cl2水解,故答案为:三颈瓶;防止空气中的水进入三颈瓶;
(3)通过E中的溶液排出戊中SO2,因此可选择饱和亚硫酸氢钠溶液;若没有乙和丁的干燥装置,会有水进入三颈瓶中,发生SO2Cl2的水解,反应方程式为SO2Cl2+2H2O=2HCl+H2SO4,
故答案为:饱和亚硫酸氢钠溶液;SO2Cl2+2H2O=2HCl+H2SO4;
(4)可利用蒸馏操作分离相互混溶的液体混合物,故答案为:蒸馏;
(5)a、铜片和浓硫酸在加热条件下只能生成SO2,而甲装置是制Cl2的,应该是浓盐酸和高锰酸钾固体,故错误;
b、可选择活性炭催化SO2和Cl2的反应,故b正确;
c、冷凝管B只起冷凝作用,蒸馏操作应在蒸馏烧瓶内进行,故c错误;
故选b;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,
故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查化学制备实验、对装置与操作的分析评价、对信息获取及应用和电极反应式的书写等,关键是明确原理,需要学生具备扎实的基础与灵活运用的能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
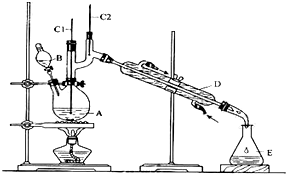
(1)将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.
(2)将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中并说明理由不能,因为浓硫酸的密度大,且溶于水放出大量的热,容易发生迸溅.
(2)若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(7)本实验中,正丁醛的产率为51%.
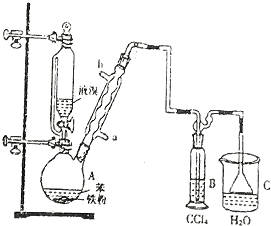
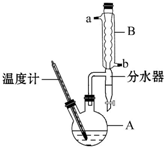 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:已知:Ⅰ.CH3CH2CH2OH+HBr$\stackrel{△}{→}$CH3CH2CH2Br+H2O
Ⅱ.2CH3CH2CH2OH$→_{140℃}^{浓硫酸}$(CH3CH2CH2)2O(正丙醚)+H2O
Ⅲ.可能用到的相关数据如下:
| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
①在A中加入50g正丙醇和一定量的浓硫酸、溴化钠一起加热(加入几粒沸石) ②保持69~72℃继续回流2小时 ③蒸馏,收集68~90℃馏出液
④用碳酸钠溶液洗至中性,分液 ⑤再蒸馏,收集68~76℃馏出液,得到纯净1-溴丙烷66g.
请回答:
(1)B装置名称是球形冷凝管,沸石的作用是防止液体暴沸.
(2)步骤①中浓硫酸、正丙醇和溴化钠的添加顺序为先加入正丙醇和溴化钠,再加入浓硫酸.
(3)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(4)为了防止副产物过多,本实验所用硫酸的浓度最好是c.
A.10% B.30% C.70% D.98.3%
(5)步骤④的目的主要是洗去硫酸,振摇后静置,粗产物应从分液漏斗的下(填“上”或“下”)口分离出.
(6)在粗产品蒸馏过程中,不可能用到的仪器有C、D(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶D.球形冷凝管 E.接收器
(7)本实验所得到的1-溴丙烷产率是C(填正确答案标号).
A.41% B.50% C.64% D.70%
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
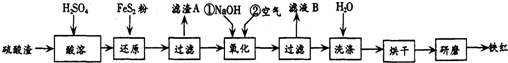
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O=15Fe2++2SO42-+16 H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2-3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
| A. | CO的生成速率与CO2的生成速率相等 | |
| B. | 气体的密度不再变化 | |
| C. | CO的质量不变 | |
| D. | 体系的压强不再发生变化 |
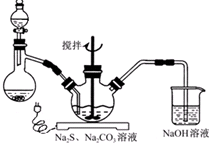 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
 .
.