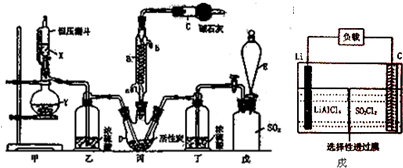
题目内容
18.铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展.(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
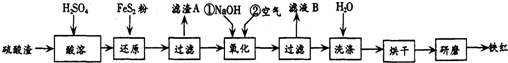
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O=15Fe2++2SO42-+16 H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2-3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
分析 (1)根据元素守恒判断X的化学式;反应中化合价升高的元素被氧化;
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
②根据得失电子守恒和原子守恒来配平;
③NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
④根据几种离子沉淀的pH分析;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠.
解答 解:(1)2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,根据元素守恒可知X的化学式为NaCl;反应中Fe(OH)3中的Fe元素是化合价升高被氧化;
故答案为:NaCl;Fe(OH)3;
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;SiO2;
②FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
故答案为:1、14、8、15、2、16H+;
③Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式,方程式为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓或Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
④根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:Al3+、Mg2+形成沉淀,使制得的铁红不纯;Na2SO4、Al2(SO4)3、MgSO4.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
| A. | 乙醇的分子式:CH3CH2OH | B. | 次氯酸的电子式: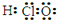 | ||
| C. | NH4Cl的电子式: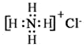 | D. | 乙醛结构简式:CH3CHO |
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | ⅣA |
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 同温同压下,H2(g)+Cl2=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 反应A(g)?2B(g),若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则该反应的△H=(Ea-Eb) kJ/mol |