题目内容
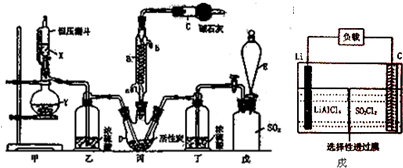
1.氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂.Ⅰ.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物,现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯等已省略).请回答:
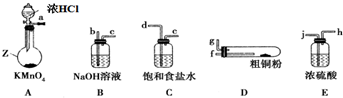
(1)装置A中仪器Z的名称为圆底烧瓶.
(2)按气流方向连接各仪器接口顺序为
a→d、e→j、h→f、g→b
(3)简述检验装置A气密性的操作:用弹簧夹夹住a处橡皮管并关闭分液漏斗的活塞,向分液漏斗中加入较多的水,然后打开分液漏斗的活塞,使水缓缓流下,若分液漏斗中的水不能完全漏下,说明装置气密性好(或在a管处接一导管,并将导管末端插入水中,同时关闭分液漏斗的活塞,用酒精灯给圆底烧瓶微热,若导管末端有气泡冒出,且停止加热恢复室温时,导管末端形成一段小水柱,说明装置气密性好).
(4)D中发生反应的化学方程式为Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(5)反应后,装置B中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该电化学腐蚀过程中正极反应式为ClO-+2e-+H2O═Cl-+2OH-,.
Ⅱ.将上述实验制得的固体产物按如图所示流程操作,请回答:

(1)用稀盐酸溶解固体的原因为抑制Cu2+、Fe3+水解.
(2)已知CuCl难溶于水,由溶液2制CuCl的离子方程式为2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-.
(3)用下面的方法测定固体产物中CuCl2的质量分数:取2.00mL溶液2转移到锥形瓶中,再加入过量的20%KI溶液,再滴入几滴淀粉溶液.用0.200mol/L Na2S2O3标准溶液滴定.反应原理为2Cu2++4I-═2CuI↓+I2、I2+2S2O32-═S4O62-+2I-.重复滴定三次,平均消耗Na2S2O3标准溶液20.00mL,则固体产物中CuCl2的质量分数为83.1%.
分析 I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物,浓盐酸和高锰酸钾发生反应生成氯气,氯气中混有氯化氢和水,可用饱和食盐水除去氯化氢,用浓硫酸干燥,加热时硬质试管中铜和氯气反应生成氯化铜,用氢氧化钠溶液吸收氯气尾气,防止污染空气,
(1)仪器A为圆底烧瓶;
(2)KMnO4与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气;
(3)利用止水夹夹住导气管的橡皮管,从长颈漏斗中加水至漏斗内外形成液面高度差,一段时间内,液面高度差不变,说明气密性良好;
(4)D中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁;
(5)装置B吸收未反应的氯气,反应生成NaCl、NaClO,NaClO具有漂白性,钢铁制品表面生成红褐色沉淀、溶液会失去漂白、杀菌消毒功效,说明ClO-在正极上得电子,发生还原反应生产Cl-,由于为碱性条件,还生成OH-;
Ⅱ.粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,再加CuO或氢氧化铜等调节pH,使铁离子转化为氢氧化铁沉淀,过滤得到的固体为氢氧化铁,溶液2为氯化铜溶液,通入二氧化硫,二氧化硫与铜离子发生氧化还原反应生成CuCl,氯化铜溶液在HCl氛围中蒸发结晶得到CuCl2•2H2O;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得关系式2n(ClCl2)~I2~2n(S2O32-),据此计算200mL溶液中n(ClCl2),进而计算ClCl2的质量分数.
解答 解:I.(1)根据装置图可知,装置A中仪器Z的名称为圆底烧瓶,
故答案为:圆底烧瓶;
(2)仪器连接顺序:Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置,所以各仪器接口顺序是:a→d、e→j、h→f、g→b;该实验中有有毒气体参加反应,所以实验前要检验装置的气密性;
故答案为:d;e;j;h;f;g;b;
(3)检验装置A的气密性的方法是:用弹簧夹夹住a处橡皮管并关闭分液漏斗的活塞,向分液漏斗中加入较多的水,然后打开分液漏斗的活塞,使水缓缓流下,若分液漏斗中的水不能完全漏下,说明装置气密性好(或在a管处接一导管,并将导管末端插入水中,同时关闭分液漏斗的活塞,用酒精灯给圆底烧瓶微热,若导管末端有气泡冒出,且停止加热恢复室温时,导管末端形成一段小水柱,说明装置气密性好),
故答案为:用弹簧夹夹住a处橡皮管并关闭分液漏斗的活塞,向分液漏斗中加入较多的水,然后打开分液漏斗的活塞,使水缓缓流下,若分液漏斗中的水不能完全漏下,说明装置气密性好(或在a管处接一导管,并将导管末端插入水中,同时关闭分液漏斗的活塞,用酒精灯给圆底烧瓶微热,若导管末端有气泡冒出,且停止加热恢复室温时,导管末端形成一段小水柱,说明装置气密性好);
(4)硬质试管中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁,反应方程式分别为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(5)根据题意,装置B中溶液含有次氯酸钠,有强氧化性,所以钢铁(含Fe、C)在该溶液中会被次氯酸根氧化,所以该电化学腐蚀过程中,次氯酸根作氧化剂在正极发生还原反应,正极反应式为ClO-+2e-+H2O═Cl-+2OH-,
故答案为:ClO-+2e-+H2O═Cl-+2OH-;
Ⅱ.(1)固体中主要是氯化铁和氯化铜,在水溶液中能水解,所以用稀盐酸溶解固体可以抑制其水解,
故答案为:抑制Cu2+、Fe3+水解;
(2)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得关系式2n(ClCl2)~I2~2n(S2O32-),故200mL溶液中n(ClCl2)=n(S2O32-)=0.02L×0.2mol/L×$\frac{200mL}{2mL}$=0.4mol,则样品中m(ClCl2)=0.4mol×135g/mol=54g,则ClCl2的质量分数为$\frac{54g}{65g}$×100%=83.1%,故答案为:83.1%.
点评 本题考查物质的制备实验方案、化学工艺流程,涉及对装置及操作的分析评价、气密性检验、电化学腐蚀、滴定计算等,侧重于基础知识的综合应用,难度中等.

| A. | NaOH、Al--电解质 | B. | C2H4、O2--易燃气体 | ||
| C. | CaC2、K--遇湿易燃物品 | D. | KMnO4、KClO3--还原剂 |
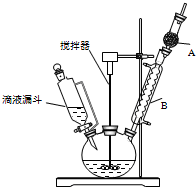 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
请回答下列问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
粗产品$\stackrel{①操作}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$三苯甲醇
其中,操作①的名称是蒸馏或分馏;洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净;
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
| A. | 乙醇的分子式:CH3CH2OH | B. | 次氯酸的电子式: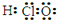 | ||
| C. | NH4Cl的电子式: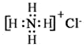 | D. | 乙醛结构简式:CH3CHO |