题目内容
16.铝片分别与①稀盐酸、②NaOH溶液反应,下列描述正确的是( )
| A. | ①中产生气泡,②中不产生气泡 | |
| B. | ①和②中都不产生气泡 | |
| C. | ①和②中都产生气泡,①中是H2,②中是O2 | |
| D. | ①和②中都产生气泡,且都是H2 |
分析 铝与稀盐酸反应生成氯化铝和氢气,铝和NaOH溶液都反应生成偏铝酸钠和氢气,由此分析解答.
解答 解:A、两者都产生氢气,都有气泡产生,故A错误;
B、两者都产生氢气,都有气泡产生,故B错误;
C、都是氢气,故C错误;
D、①和②中都产生气泡,且都是H2,故D正确;
故选D.
点评 本题考查铝与酸和碱的反应,两者都与非氧化性的酸和碱反应产生氢气,比较容易.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入NO2,产生沉淀 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶 | |
| C. | 碳酸钙不溶于水,只有在熔融状态下才是强电解质 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率加快 |
4.根据碳原子的成键特点,甲烷分子中形成共价键的数目为( )
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
1.某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)

(1)写出圆底烧瓶中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有酸性氧化物的通性(性质),试管2是为了证明SO2具有氧化性(性质).
(3)除上述两种性质外,你认为SO2还具有的性质是还原性(或漂白性),可以通过加入KMnO4溶液(或品红)(填试剂化学式或者名称)加以证明.
(4)经过实验,观察到如下实验现象:
①试管1中紫色石蕊溶液变红.
②试管2中有浅黄色浑浊出现,写出反应的化学方程式2H2S+SO2=3S↓+2H2O.
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀.将产生的沉淀的化学式填入下表相应位置.
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是3是验证性质,5是吸收.

(1)写出圆底烧瓶中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有酸性氧化物的通性(性质),试管2是为了证明SO2具有氧化性(性质).
(3)除上述两种性质外,你认为SO2还具有的性质是还原性(或漂白性),可以通过加入KMnO4溶液(或品红)(填试剂化学式或者名称)加以证明.
(4)经过实验,观察到如下实验现象:
①试管1中紫色石蕊溶液变红.
②试管2中有浅黄色浑浊出现,写出反应的化学方程式2H2S+SO2=3S↓+2H2O.
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀.将产生的沉淀的化学式填入下表相应位置.
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
8.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H<0.一定条件下测得反应过程中n(Cl2)的实验数据如下.下列说法正确的是( )
表一
表二
表一
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
5.下列有关金属及其化合物的说法正确的是( )
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
6.下列物质不属于高分子化合物的是( )
| A. | 油脂 | B. | 羊毛 | C. | 淀粉 | D. | 橡胶 |
 电池的发明和应用是化学家们对人类社会的重要贡献之一.
电池的发明和应用是化学家们对人类社会的重要贡献之一. $→_{②}^{NaOH,乙醇}$
$→_{②}^{NaOH,乙醇}$ $→_{③}^{Br_{2}的CCl_{4}溶液}$B
$→_{③}^{Br_{2}的CCl_{4}溶液}$B
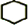 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$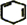 +2NaBr+2H2O.
+2NaBr+2H2O.