题目内容
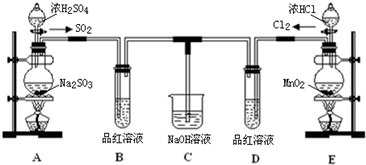
1.某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)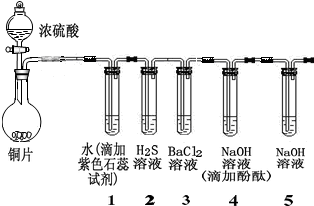
(1)写出圆底烧瓶中发生反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有酸性氧化物的通性(性质),试管2是为了证明SO2具有氧化性(性质).
(3)除上述两种性质外,你认为SO2还具有的性质是还原性(或漂白性),可以通过加入KMnO4溶液(或品红)(填试剂化学式或者名称)加以证明.
(4)经过实验,观察到如下实验现象:
①试管1中紫色石蕊溶液变红.
②试管2中有浅黄色浑浊出现,写出反应的化学方程式2H2S+SO2=3S↓+2H2O.
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀.将产生的沉淀的化学式填入下表相应位置.
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
分析 根据实验装置图可知,圆底烧瓶中用铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,将生成的二氧化硫通入到石蕊溶液中,由于二氧化硫溶于水生成亚硫酸,所以石蕊溶液会变红色,将二氧化硫通入到硫化氢溶液中,二氧化硫有氧化性,能与硫化氢反应生成硫单质,所以可以看到试管2中有浅黄色浑浊出现,由于二氧化硫溶于水生成的亚硫酸是弱酸,所以通入到氯化钡溶液中,不能产生沉淀,所以试管3中无明显现象,二氧化硫为酸性氧化物能与氢氧化钠反应,所以二氧化硫通过有酚酞的氢氧化溶液,溶液的红色会褪色,二氧化硫有毒,所以实验最后要用氢氧化钠溶液进行尾气吸收,据此答题.
解答 解:根据实验装置图可知,圆底烧瓶中用铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,将生成的二氧化硫通入到石蕊溶液中,由于二氧化硫溶于水生成亚硫酸,所以石蕊溶液会变红色,将二氧化硫通入到硫化氢溶液中,二氧化硫有氧化性,能与硫化氢反应生成硫单质,所以可以看到试管2中有浅黄色浑浊出现,由于二氧化硫溶于水生成的亚硫酸是弱酸,所以通入到氯化钡溶液中,不能产生沉淀,所以试管3中无明显现象,二氧化硫为酸性氧化物能与氢氧化钠反应,所以二氧化硫通过有酚酞的氢氧化溶液,溶液的红色会褪色,二氧化硫有毒,所以实验最后要用氢氧化钠溶液进行尾气吸收,
(1)圆底烧瓶中用铜与浓硫酸在加热的条件下生成硫酸铜和二氧化硫,反应的方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)根据上面的分析可知,从实验目的分析,试管1、4的目的都是为了证明SO2具有 酸性氧化物的通性,试管2是为了证明SO2具有 氧化性,
故答案为:酸性氧化物的通性;氧化性;
(3)根据所学二氧化硫的知识可知,SO2还具有的性质是 还原性(或漂白性),可以通过加入 KMnO4溶液(或品红)加以证明,
故答案为:还原性(或漂白性);KMnO4溶液(或品红);
(4)根据上面的分析可知,①试管1中 观察到到的实验现象为紫色石蕊溶液变红,
故答案为:紫色石蕊溶液变红;
②试管2中有浅黄色浑浊出现为硫,反应的化学方程式为 2H2S+SO2=3S↓+2H2O,
故答案为:2H2S+SO2=3S↓+2H2O;
(5)试管4中无明显现象,将其分成两份,如果一份中能入氧气,氧气能将亚硫酸氧化成硫酸,则与氯化钡会产生硫酸钡沉淀,化学式为BaSO4,另一份加入氨水,与二氧化硫反应生成亚硫酸铵,亚硫酸铵能与氯化钡反应生成亚硫酸钡沉淀,化学式为BaSO3,
故答案为:
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
(6)根据上面的分析可知,试管4的实验目的是验证二氧化硫的酸性氧化物的通性,而试管5的目的是吸收二氧化硫尾气,防止污染空气,
故答案为:3是验证性质,5是吸收.
点评 本题考查了物质性质的探究实验方法,装置的特征分析,各装置中的反应和试剂作用是解题关键,题目难度中等.

| A. | 2H2O(g)═2H2(g)+O2(g)△H=-483.6 kJ•mol-1(△H代表反应热) | |
| B. | C(s)+O2(g)═CO2(g)△H=+393.5kJ/mol((△H代表反应热) | |
| C. | 2HNO3(aq)+Ba(OH)2(aq)═Ba(NO3)2(aq)+2H2O(l);△H=+114.6KJ/mol(△H代表反应热) | |
| D. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol((△H代表中和热) |
 右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )
右图是用点滴板探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板.下列对实验现象的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
| B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
| C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-→Al(OH)3↓ |
| D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl→NH4Cl |
| A. | A | B. | B | C. | C | D. | D |
| A. | 维生素和淀粉遇碘水均显蓝色 | |
| B. | 蛋白质、乙酸和葡萄糖均属电解质 | |
| C. | 溴乙烷与NaOH乙醇溶液共热生成乙烯 | |
| D. | 乙酸乙酯和食用植物油均可水解生成乙醇 |

| A. | ①中产生气泡,②中不产生气泡 | |
| B. | ①和②中都不产生气泡 | |
| C. | ①和②中都产生气泡,①中是H2,②中是O2 | |
| D. | ①和②中都产生气泡,且都是H2 |
| A. | 反应后溶液可能呈中性 | |
| B. | 反应停止后一定有固体剩余 | |
| C. | 反应过程中一定有氧化还原反应发生 | |
| D. | 若只有Cu剩余,向溶液中滴入铁氰化钾溶液不会产生蓝色沉淀 |
| A. | 水 | B. | 新制Cu(OH)2 | C. | NaOH溶液 | D. | 石蕊试剂 |
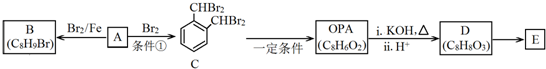
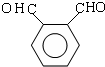 .
.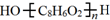 .D→E的化学方程式是n
.D→E的化学方程式是n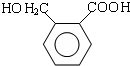 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$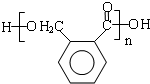 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).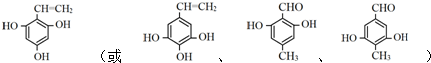 (写1种即可).
(写1种即可).