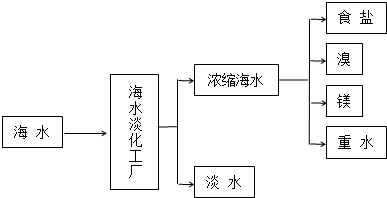
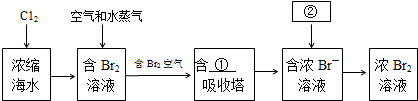
题目内容
5.液态化合物XY2与标准状况下3.36L O2恰好完全反应,化学方程式为XY2(液态)+3O2(气态)$\frac{\underline{\;点燃\;}}{\;}$XO2(气态)+2YO2(气态).①XY2的物质的量为0.05mol.
②完全燃烧后恢复到标准状况下,XO2和YO2均为气态,所得的混合气体的体积为3.36L.
分析 ①液态化合物XY2和氧气的物质的量之比是1:3;
②根据V=nVm进行计算回答.
解答 解:①液态化合物XY2与标准状况下3.36L即0.15mol O2恰好完全反应,液态化合物XY2和氧气的物质的量之比是1:3,所以液态化合物XY2的物质的量是0.05mol,
故答案为:0.05mol;
②完全燃烧后XO2和YO2分别为0.05mol、0.1mol,恢复到标准状况下,所得的混合气体的体积为(0.05mol+0.1mol)×22.4L/mol=3.36L.
故答案为:3.36L.
点评 本题考查化学方程式的有关计算,难度中等,关键是根据方程式计算,侧重考查学生对数据的处理与分析解决问题的能力.

练习册系列答案
相关题目
16.下列离子方程式正确的是( )
| A. | 用NaOH溶液吸收Cl2:Cl2+2OH-=2Cl-+H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- | |
| D. | 向NaHCO3-溶液中加入澄清石灰水:HCO+OH-=CO32-+H2O |
13.下列关于晶体结构的描述正确的是( )
| A. | 冰中存在极性键、非极性键、范德华力、氢键 | |
| B. | MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大 | |
| C. | 等质量的金刚石晶体和石墨晶体含有的碳碳σ键数目相同 | |
| D. | 干冰的晶胞中CO2分子数目和金属铜的晶胞中Cu原子数目相同 |
10.下列事实不属于盐类水解应用的是( )
| A. | 明矾净水 | |
| B. | 使用热的纯碱溶液去除油污 | |
| C. | 实验室配制FeCl3溶液时加入少量稀盐酸 | |
| D. | 实验室制氢气时加入CuSO4可加快反应速率 |
14.某溶液在常温下由水电离出的OH-是10-13 mol/L,该溶液中一定不能大量共存的是( )
| A. | K+、CO32-、S2-、Cl- | B. | NO3-、Br-、Na+、NH4+ | ||
| C. | Na+、K+、Cl-、HS- | D. | Na+、NO3-、Fe3+、SO4- |
15.下列变化一定属于化学变化的是( )
| A. | 用干冰人工降雨 | B. | 装澄清石灰水的瓶壁上有一层白膜 | ||
| C. | 霓虹灯发出五颜六色的光 | D. | 各种爆炸 |
 ,最简单烯烃的结构简式为
,最简单烯烃的结构简式为 ,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为
,最简单芳香烃的分子式为C6H6,C4H10 的一氯代物有4种,C5H12 的同分异构体中沸点最低的物质 的结构简式为 .
.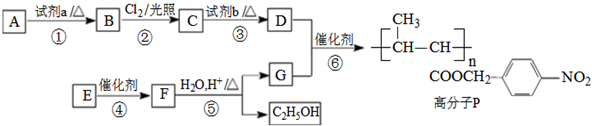
 .
.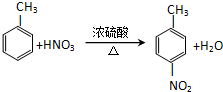 .
.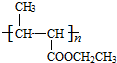 +nH2O$→_{△}^{H+}$
+nH2O$→_{△}^{H+}$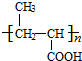 +n CH3CH2OH.
+n CH3CH2OH.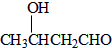 以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).