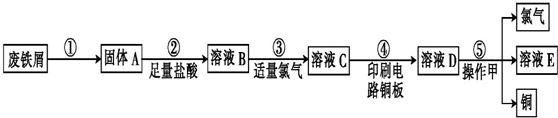
题目内容
17.浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据如图回答问题.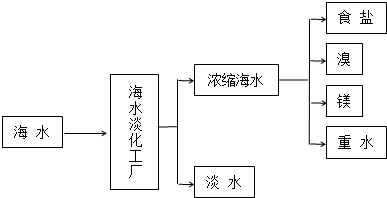
(1)海水淡化工厂通常采用的制备淡水的方法有蒸馏法、电渗析法(写出两种).
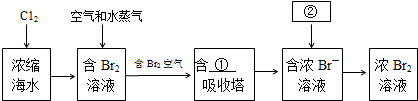
(2)如图是从浓缩海水中提取溴的流程图.写出下图中①②的化学式:①SO2,②Cl2,吸收塔中发生的化学反应方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是MgO的熔点为2800℃、熔点高,电解时耗能高.
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12.海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜.电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是防止H2与C12混合发生爆炸,同时防止C1-进入阴极室,这样可以获得纯净的NaOH.
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(g)?4SiHCl3(g).达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为0.35 kg.
分析 (1)目前淡化海水的方法有多种,常用方法有蒸馏、电渗析以及离子交换法等,以此解答.
(2)从浓缩海水中提取溴,先进行溴离子的氧化得到溴单质,利用二氧化硫吸收溴单质富集得到溴离子,最后再次用氯气氧化;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高;
(4)食盐水中含有杂质离子Mg2+、Ca2+,一定条件下生成沉淀损害离子交换膜;根据电解食盐水的产物之间能反应;
(5)利用三段分析法,根据平衡时H2与SiHCl3物质的量浓度,求出的起始物质的量,再根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,求出理论上消耗纯NaCl的质量.
解答 解:(1)目前淡化海水的方法有多种,海水淡化工厂通常采用的制备淡水的方法有蒸馏法、电渗析法;
故答案为:蒸馏法、电渗析法;
(2)从浓缩海水中提取溴,先进行溴离子的氧化得到 溴单质,利用二氧化硫吸收溴单质的富集得到溴离子,最后再次用氯气氧化,吸收塔中发生的化学反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2;Cl2;SO2+Cl2+2H2O=H2SO4+2HCl;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁;
故答案为:MgO的熔点为2800℃、熔点高,电解时耗能高;
(4)用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜,所以要用阳离子交换塔除去Mg2+、Ca2+;电解食盐水的产物有氯气、氢气和氢氧化钠,氯气与氢氧化钠能反应,氢气与氯气也能反应,所以电解食盐水在离子交换膜电解槽中进行;
故答案为:用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与C12混合发生爆炸,同时防止C1-进入阴极室,这样可以获得纯净的NaOH;
(5)由3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x 4x
平衡量(mol) n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,
2mol 1mol
m(NaCl)=350g=0.35kg;
故答案为:0.35.
点评 本题考查了海水提取镁的过程分析,是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验E中的金属呈红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
①NaH电子式Na+[:H]-
②乙烯的结构式:CH2=CH2
③水分子的球棍模型:

④硫原子的外围电子排布式为3s23p4
⑤氟化铵的分子式:NH4F.
| A. | ①③④ | B. | ①④ | C. | ②③⑤ | D. | 除② |
| A. | NH4+、K+、SO42-、Br- | B. | K+、Na+、AlO2-、Cl- | ||
| C. | Fe3+、K+、SO42-、NO3- | D. | K+、Na+、NO3-、I- |
| A. | KNO3 | B. | NH4Cl | C. | NaHCO3 | D. | NaHSO4 |
| A. | 硫化亚铁和稀盐酸反应:FeS+2H+=Fe2++H2S↑ | |
| B. | 次氯酸钠溶液中通入少量SO2反应:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | 过氧化钠加入足量稀硫酸反应:2Na2O2+4H+═4Na++O2↑+2H2O | |
| D. | 铜粉中加入溴化铁溶液反应:2Fe3++Cu=2Fe2++Cu2+ |
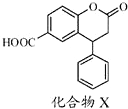
| A. | 分子式为C16H14O4 | |
| B. | 1mol化合物X在一定条件下最多加成6molH2 | |
| C. | 分子中有三种官能团,酸性条件下水解后官能团还是三种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |