题目内容
13.下列关于晶体结构的描述正确的是( )| A. | 冰中存在极性键、非极性键、范德华力、氢键 | |
| B. | MCO3型碳酸盐,其分解温度越高,则分解后生成的金属氧化物的晶格能越大 | |
| C. | 等质量的金刚石晶体和石墨晶体含有的碳碳σ键数目相同 | |
| D. | 干冰的晶胞中CO2分子数目和金属铜的晶胞中Cu原子数目相同 |
分析 A.根据水分子的结构和晶体类型分析;
B.MCO3型碳酸盐,如碳酸钡最难分解,但分解后生成的金属氧化物氧化钡的晶格能比同主族上周期的小;
C.石墨中每个C只形成3对共价键;
D.干冰的晶胞中CO2数目为4,金属铜的晶胞中Cu原子数目为4.
解答 解:A.根据水分子的结构式:H-O-H,可知,水分子中没有非极性键,故A错误;
B.MCO3型碳酸盐,其分解温度越高,但分解后生成的金属氧化物的晶格能越小,故B错误;
C.12 g金刚石中含2 mol C-C键,12 g石墨中含有1.5 mol C-C键,故C错误;
D.根据干冰和Cu的晶胞模型可知:干冰的晶胞中CO2数目为4,金属铜的晶胞中Cu原子数目为4,故D正确;
故选D.
点评 本题考查晶体类型与化学键知识,题目难度较大,注意晶胞模型的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
1.下列说法正确的是( )
| A. | 分子中含有羟基的物质溶于水后,溶液一定显酸性 | |
| B. | 丙酸、乙酸甲酯、甲酸乙酯互为同分异构体 | |
| C. | 能发生银镜反应的一定是醛 | |
| D. | 乙醇发生酯化反应断裂碳氧键而失去羟基 |
8.下列有关化学用语的表示方法正确的有( )
①NaH电子式Na+[:H]-
②乙烯的结构式:CH2=CH2
③水分子的球棍模型:
④硫原子的外围电子排布式为3s23p4
⑤氟化铵的分子式:NH4F.
①NaH电子式Na+[:H]-
②乙烯的结构式:CH2=CH2
③水分子的球棍模型:

④硫原子的外围电子排布式为3s23p4
⑤氟化铵的分子式:NH4F.
| A. | ①③④ | B. | ①④ | C. | ②③⑤ | D. | 除② |
2.下列物质的水溶液因溶质电离显酸性的是( )
| A. | KNO3 | B. | NH4Cl | C. | NaHCO3 | D. | NaHSO4 |
3.下列有关化学反应类型的判断,错误的是( )
| 选项 | 化学方程式 | 反应类型 |
| A | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | 化合反应 |
| B | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | 分解反应 |
| C | BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 | 复分解反应 |
| D | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | 置换反应 |
| A. | A | B. | B | C. | C | D. | D |


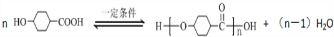 .
. .
. .
.