题目内容
10.有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素的一种氧化物为淡黄色固体,该固体放置在空气中能生成A的单质,C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子.(1)写出A,C 元素符号:AOCMg
(2)B的离子结构示意图:
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.(3)比较D的气态氢化物与H2S和HF的稳定性:HF>HCl>H2S
(4)C与D两元素最高价氧化物的水化物反应的离子方程式Mg(OH)2+2H+=Mg2++2H2O.
分析 短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,由电子守恒可得:$\frac{2.4g}{Mg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2×(1-0),解得M=24,其质子数=24-12=12,则C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素,然后利用元素及其单质、化合物的性质来解答.
解答 解:短周期元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A的质子数为8,即A为O元素;B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,由电子守恒可得:$\frac{2.4g}{Mg/mol}$×2=$\frac{2.24L}{22.4L/mol}$×2×(1-0),解得M=24,其质子数=24-12=12,则C为Mg元素;D的M层上7个电子,则D在第三周期第ⅦA族,则D为Cl元素,
(1)由上述分析可知,A为O,C为Mg,
故答案为:O;Mg;
(2)B为Na元素,质子数为11,其离子的结构示意图为 ;D为Cl元素,原子序数为17,处于周期表中第三周期VIIA族,
;D为Cl元素,原子序数为17,处于周期表中第三周期VIIA族,
故答案为: ;第三周期VIIA族;
;第三周期VIIA族;
(3)非金属性越强,氢化物越稳定,非金属性F>Cl>S,则氢化物稳定性为:HF>HCl>H2S,
故答案为:HF>HCl>H2S;
(4)C与D两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,
故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查位置结构性质的关系,题目难度中等,熟悉物质的性质、利用氧化还原反应中电子守恒等来推断元素是解答本题的关键,注意掌握元素周期表结构、元素周期律内容.

(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在表②③⑥的后面.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2CO3 | ⑦CO2 ⑧Na2O2 |
(3)实验室制备⑦常用石灰石和盐酸反应,检验该气体的方法是Ca(OH)2+CO2═CaCO3+H2O.(化学方程式)
| A. | 溶液的浓度增大 | |
| B. | 溶液的pH增大 | |
| C. | 溶液中钠离子与碳酸根离子的物质的量之比变小 | |
| D. | 溶液的质量分数不变 |
| A. | 通氢气的一极是正极,通氧气的一极是负极 | |
| B. | 通氢气的一极发生的是还原反应 | |
| C. | 工作一段时间后电解质溶液的pH值减小 | |
| D. | 工作时负极区附近的pH值增大 |
| A. | 黄砷中共价键键能大于白磷 | B. | 黄砷的熔点高于白磷 | ||
| C. | 黄砷易溶于水 | D. | 分子中共价键键角均为109°28′ |
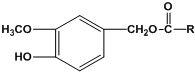 (R为烃基)
(R为烃基)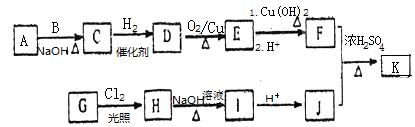
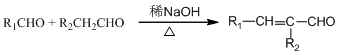
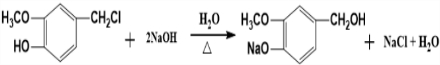 ,
,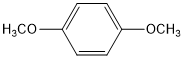 ,
,

 B.
B. C.泡利原理 D.洪特规则
C.泡利原理 D.洪特规则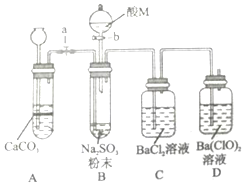 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置: