题目内容
2.钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途.(1)写出Ti的基态原子的外围电子排布式3d24S2;
(2)TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于分子晶体;BH4-中B原子的杂化类型为sp3;
(3)在 TiO2催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子化学式为CO2(或N2O、CS2、BeCl2等).(填一种)
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2•H2O(绿色),两者配位数相同(填“相同”或“不同”),绿色晶体中配体是Cl-、H2O.
(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为[TiO]n2n+.
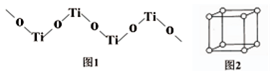
(6)简单立方晶胞如图2.若果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为($\sqrt{3}$-1)r的一个原子(用含r的代数式表示).
分析 (1)Ti是22号元素,原子核外电子数为22,根据能量最低原理书写价电子排布式;
(2)根据题目中提供的物理性质TiCl4在常温下是无色液体,熔点是-25℃,沸点136.4℃,来判断晶体类型;根据价层电子对互斥理论确定B原子的杂化类型;
(3)根据等电子体是指具有相同电子数目和原子数目的分子或离子来回答;
(4)根据配合物的结构分析,內界离子数为配位数,据此分析配体;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比,Ti元素为+4价、O元素为-2价,据此书写其化学式;
(6)半径为r的原子保持紧密接触,则晶胞的边长2r,面对角线长为$\sqrt{(2r)^{2}+(2r)^{2}}$=2$\sqrt{2}$r,体对角线长为$\sqrt{(2\sqrt{2}r)^{2}+(2r)^{2}}$=2$\sqrt{3}$r,故立方体的中心能容得下半径最大为$\frac{2\sqrt{3}r-2r}{2}$=($\sqrt{3}$-1)r.
解答 解:(1)Ti是22号元素,原子核外电子数为22,元素基态原子的电子排布式1s22s22p63s23p63d24S2,则价电子排布式为:3d24S2,
故答案为:3d24S2;
(2)因TiCl4在常温下是无色液体,熔点是-25℃,沸点136.4℃,熔沸点低,由此可判断 TiCl4是由共价键结合的分子,晶体类型属于分子晶体,BH4-中B原子价层电子数=4+$\frac{1}{2}$(3+1-4×1)=4,且不含孤电子对,B原子是sp3杂化,BH4-是正四面体构型,
故答案为:分子;sp3;
(3)CNO-中电子数为:6+7+8+1=22,与CO2具有相同电子数目和原子数目,是等电子体,常见粒子还有N2O、CS2、BeCl2等;
故答案为:CO2(或N2O、CS2、BeCl2等);
(4)[Ti( H2O)6]Cl3(紫色),配体为:H2O,配位数为6,[TiCl(H2O)5]Cl2•H2O(绿色),配体为Cl-、H2O,配位数为6,两者配位数相同,
故答案为:相同;Cl-、H2O;
(5)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比为1:1;
Ti元素为+4价、O元素为-2价,据此书写其化学式为[TiO]n2n+,
故答案为:[TiO]n2n+;
(6)半径为r的原子保持紧密接触,则晶胞的边长2r,面对角线长为$\sqrt{(2r)^{2}+(2r)^{2}}$=2$\sqrt{2}$r,体对角线长为$\sqrt{(2\sqrt{2}r)^{2}+(2r)^{2}}$=2$\sqrt{3}$r,故立方体的中心能容得下半径最大为$\frac{2\sqrt{3}r-2r}{2}$=($\sqrt{3}$-1)r,
故答案为:($\sqrt{3}$-1)r.
点评 本题考查物质结构和性质,涉及核外电子排布、等电子体、杂化方式的判断、晶胞的计算等知识点,难点是晶胞的计算,灵活运用公式是解本题关键,题目难度中等.

①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀.
| A. | ①②③ | B. | ②③⑤ | C. | ②③④ | D. | 全部 |
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn ),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是 222 | |
| B. | Se 是人体必需的微量元素,${\;}_{34}^{78}$Se 和${\;}_{34}^{80}$Se 互为同位素 | |
| C. | ${\;}_{92}^{235}$U 的浓缩一直被国际社会关注,${\;}_{92}^{235}$U 与 ${\;}_{92}^{238}$U 是两种不同的核素 | |
| D. | ${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C 的中子数为 6 |
| A. | 发生装置与用KClO3制取O2的装置相同 | |
| B. | 可用浓硫酸干燥氨气 | |
| C. | 可用向下排空气法收集氨气 | |
| D. | 氨气的验满可以用蘸有浓盐酸的玻璃棒放于试管口附近 |
| A. | 人类目前所直接利用的能量大部分是由化学反应产生的 | |
| B. | 氢氧燃料电池工作过程中,热能转变为电能 | |
| C. | 电解水制取H2过程中,电能转变为化学能 | |
| D. | 生物质能源是可再生能源 |
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.
 .
. .
.