题目内容
9.在0.1mol•L-1 Na2CO3溶液中,欲使CO32-的浓度尽量接近0.1mol•L-1,则应向溶液中加( )| A. | HCl | B. | Na2CO3 | C. | NaCl | D. | KOH |
分析 Na2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1mol/L,如果要使c(CO32-)更接近于0.1mol/L,则需要抑制碳酸根离子水解,根据水解平衡的移动影响因素来回答.
解答 解:如果要使c(CO32-)更接近于0.1mol/L,抑制碳酸根离子水解的条件即可.
A、加入盐酸会和碳酸根反应生成水和二氧化碳,碳酸根离子浓度减小,故A错误;
B、通加Na2CO3,导致CO32-浓度增大,故B正确;
C、NaCl固体无影响,如果加溶液,相当于加入水稀释会导致溶液中离子浓度减小,故C错误;
D、加入氢氧化钾固体,会抑制碳酸根水解,使得碳酸根浓度接近0.1mol/L,故D正确.
故选BD.
点评 本题考查学生盐的水解平衡的影响因素知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
相关题目
6.下列溶液中不存在配离子的是( )
| A. | CuSO4水溶液 | B. | 银氨溶液 | C. | 硫氰化铁溶液 | D. | I2的CCl4溶液 |
7.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH<5的溶液中:NH4+、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- | |
| D. | 在滴加石蕊变蓝的溶液中:Na+、S2-、CO32-、K+ |
4.一定质量的Cu-Zn合金溶于足量的热浓硫酸中(忽略副反应),溶液所增加的质量与原合金质量之比为1:A,则原合金中Zn、Cu的质量之比为( )
| A. | 65:(A-65) | B. | 64:(A-65) | C. | 65:(A-64) | D. | 64:(A-64) |
14.粗盐提纯时不需用到的玻璃仪器是( )
| A. | 量筒 | B. | 玻璃棒 | C. | 三角漏斗 | D. | 容量瓶 |
1. 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H<0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |
18.下列说法正确的是( )
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 通过化学变化可以实现235U与238U的相互转化 | |
| C. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| D. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
19.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1mol/L NH4Cl溶液:c(NH4+)=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后:c(H+)=c(CH3COO-)+c(OH-) |
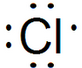 .
.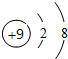 .
.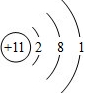 D2-的电子式为
D2-的电子式为 .
. ;Z元素原子的电子式为
;Z元素原子的电子式为 .
.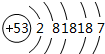 .
.