题目内容
6.下列电子书写正确的是( )| A. | 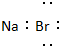 | B. |  | C. |  | D. |  |
分析 A.溴化钠为离子化合物,离子方程式中需要标出阴阳离所带电荷;
B.氯化镁为离子化合物,阴阳离子需要标出所带电荷,阴离子需要标出最外层电子;
C.次氯酸中不存在氢氯键,其分子中存在1个氧氢键和1个氧氯键;
D.二氧化碳分子中含有两个碳氧双键,碳原子最外层为8个电子.
解答 解:A.溴化钠为离子化合物,电子式中钠离子直接用离子符号表示,溴离子需要标出最外层电子及所带电荷,溴化钠正确的离子方程式为: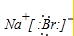 ,故A错误;
,故A错误;
B.氯化镁为离子化合物,氯离子需要标出最外层电子,氯化镁的电子式为: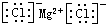 ,故B错误;
,故B错误;
C.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸的电子式为: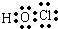 ,故C正确;
,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是CCl4层呈紫色
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+.
(2)已知:I2+2S2O32-=2I-+S4O62-某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是CCl4层呈紫色
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+.
(2)已知:I2+2S2O32-=2I-+S4O62-某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ | |
| B. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O |
14.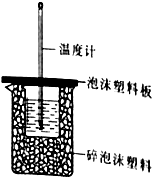 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |
1.除去CO2中混有的少量SO2气体,最好选用的试剂是( )
| A. | 澄清石灰水 | B. | 品红溶液 | C. | NaOH溶液 | D. | 饱和NaHCO3溶液 |
11.现有部分前36号元素的性质或原子结构如下表:
(1)写出R元素与同周期相邻元素的第一电离能由大到小的顺序,(用元素符号表示)N>O>C.
(2)S元素的常见化合价为-1,其基态原子的价电子排布图为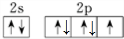
(3)T元素的原子N能层上电子数为2.
(4)X的电子排布图违背了能量最低原理.用X单质、碱金属盐及碱土金属盐等可以做成焰火.燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量.
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X |  |
(2)S元素的常见化合价为-1,其基态原子的价电子排布图为

(3)T元素的原子N能层上电子数为2.
(4)X的电子排布图违背了能量最低原理.用X单质、碱金属盐及碱土金属盐等可以做成焰火.燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量.
18.下列物质不能直接由单质经化合反应得到的是( )
| A. | FeCl3 | B. | Mg3N2 | C. | SO3 | D. | Cu2S |
15.某微粒用AZRn+表示,下列关于该微粒的叙述不正确的是( )
| A. | 所含质子数=z | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A |
16.下列热化学方程式能表示可燃物的燃烧热的是( )
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |