题目内容
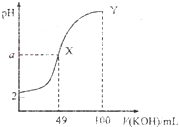 常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )
常温下向100mL0.1mol?L-1HA溶液中逐滴加入0.2mol?L-1KOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计),已知X点溶液呈中性.下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、X点溶液的温度高于Y点 |
| C、X点水的电离程度大于Y点水的电离程度 |
| D、Y点对应点的溶液中c(K+)>c(A-)>c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.根据图示可知,0.1mol?L-1HA溶液的pH=2,说明溶液中 HA在溶液中部分电离;
B.X点为中性,则混合液的pH=7,而Y点加入100mL氢氧化钾,溶液体积增大,温度减小;
C.X点为中性,此时水正常电离,而Y点氢氧化钾过量,溶液显示碱性,抑制了水的电离;
D.Y点HA与氢氧化钾恰好反应生成KA,A-部分水解,溶液显示碱性.
B.X点为中性,则混合液的pH=7,而Y点加入100mL氢氧化钾,溶液体积增大,温度减小;
C.X点为中性,此时水正常电离,而Y点氢氧化钾过量,溶液显示碱性,抑制了水的电离;
D.Y点HA与氢氧化钾恰好反应生成KA,A-部分水解,溶液显示碱性.
解答:
解:A.HA若是强酸,则0.1mol?L-1HA溶液的pH=1,而图象中溶液的pH=2,则HA部分电离,则HA为一元弱酸,故A正确;
B.X点溶液为中性,此时溶液基本完全中和,温度较高,而Y点加入100mL氢氧化钾溶液后,溶液体积增大,温度降低,所以X点温度大于Y,故B正确;
C.X点时混合液为中性,此时水正常电离,而Y点加入100mL氢氧化钾溶液后,氢氧化钾过量,氢氧根离子抑制了水的电离,所以X点水的电离程度大于Y点,故C正确;
D.Y点加入100mL氢氧化钾溶液后,氢氧根离子浓度大于0.05mol/L,而A-部分水解,溶液中A-部分水解的浓度小于0.05mol/L,则溶液中离子浓度大小为:c(K+)>c(OH-)>c(A-),故D错误;
故选D.
B.X点溶液为中性,此时溶液基本完全中和,温度较高,而Y点加入100mL氢氧化钾溶液后,溶液体积增大,温度降低,所以X点温度大于Y,故B正确;
C.X点时混合液为中性,此时水正常电离,而Y点加入100mL氢氧化钾溶液后,氢氧化钾过量,氢氧根离子抑制了水的电离,所以X点水的电离程度大于Y点,故C正确;
D.Y点加入100mL氢氧化钾溶液后,氢氧根离子浓度大于0.05mol/L,而A-部分水解,溶液中A-部分水解的浓度小于0.05mol/L,则溶液中离子浓度大小为:c(K+)>c(OH-)>c(A-),故D错误;
故选D.
点评:本题考查了酸碱混合的定性判断及溶液中离子浓度大小比较,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确盐的水解原理及其应用方法,正确分析图象曲线变化为解答关键.

练习册系列答案
相关题目
在核反应方程
He+
N→
O+X中,X代表的粒子是( )
4 2 |
14 7 |
17 8 |
A、
| ||
B、
| ||
C、
| ||
D、
|
用四氯化碳萃取碘水中的碘,下列说法中不正确的是( )
| A、实验使用的主要仪器是分液漏斗 |
| B、碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C、碘的四氯化碳溶液呈紫红色 |
| D、分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出 |
制取一氯乙烷最好采用的方法是( )
| A、乙烷和氯气反应 |
| B、乙烯和氯气反应 |
| C、乙烯和氯化氢反应 |
| D、乙烯和氯气、氢气反应 |
下列说法不正确的是( )
| A、汽油可由石油分馏和石油的催化裂化获得,可用作燃料 |
| B、利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| C、由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
| D、蔗糖及其水解产物中,只有一种物质能与新制氢氧化铜反应生成砖红色沉淀 |
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4═FeSO4+H2↑ | ||||
B、CO+CuO
| ||||
C、Cu2(OH)2CO3
| ||||
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
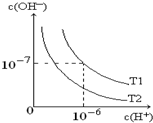 如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答:
如图是在温度T1、T2时溶液中c(H+)、c(OH-)变化关系图,试回答: