题目内容
12. 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:完成下列填空:
(1)写出A中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
采用可抽动铜丝进行实验的优点是可以控制反应的进行.
(2)反应一段时间后,可观察到B试管中的现象为变红.
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是NH3、
Cl2.(要求填一种化合物和一种单质的化学式)
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是过滤.该黑色不溶物不可能是CuO,理由是CuO会溶于稀硫酸中.
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
| 实验装置 | 实验现象 |
 | 品红褪色 |
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为Cu2S.
分析 (1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式,抽动铜丝可以控制铜丝与浓硫酸接触面积;
(2)依据二氧化硫酸性氧化物的性质解答;
(3)二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸;
(4)分离固体与液体用过滤,氧化铜与酸反应生成铜离子与水,据此解答;
(5)黑色固体通入氧气反应生成气体能够使品红褪色,说明生成二氧化硫,含有硫元素;
若该黑色不溶物由两种元素组成且在反应前后质量保持不变,可知除了含有硫元素外还含有铜,物质为硫化亚铜.
解答 解:(1)浓硫酸和铜在加热的条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,抽动铜丝可以控制铜丝与浓硫酸接触面积从而控制反应进行;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;可以控制反应的进行;
(2)反应生成二氧化硫,二氧化硫为酸性氧化物,能够与水反应生成亚硫酸,溶液显酸性,遇到石蕊显红色;
故答案为:变红;
(3)向BaCl2溶液中通入另一种气体,产生白色沉淀,是因为二氧化硫不与氯化钡溶液反应,通入的气体需要满足把二氧化硫转化为盐或把二氧化硫氧化为硫酸,如碱性气体NH3、做氧化剂的气体如Cl2、O2、O3、NO2、Cl2O等,
故答案为:NH3 Cl2 ;
(4)将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离固体与液体可以采用过滤法;氧化铜与酸反应生成铜离子与水,所以黑色固体不可能为氧化铜;
故答案为:过滤;CuO会溶于稀硫酸中;
(5)黑色固体通入氧气反应生成气体能够使品红褪色,说明生成二氧化硫,含有硫元素;
若该黑色不溶物由两种元素组成且在反应前后质量保持不变,可知除了含有硫元素外还含有铜,物质为硫化亚铜,化学式:Cu2S;
故答案为:硫;Cu2S;
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,明确物质的性质是解题关键,注意实验设计的严密性,题目难度中等.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | 通入澄清石灰水 | B. | 用品红溶液 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 根据有无毒性 |
| A. | 破坏了金属键 | B. | 破坏了共价键 | C. | 破坏了离子键 | D. | 形成了共价键 |
| A. | 取样,进行焰色反应 | |
| B. | 取样,滴加酚酞试液 | |
| C. | 取样,加入足量稀HNO3,再滴加AgNO3溶液 | |
| D. | 取样,加入足量BaCl2溶液,再滴加紫色石蕊试液 |
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
| A. | 硝化甘油 | B. | 苯 | C. | 重晶石 | D. | 硝酸铵 |
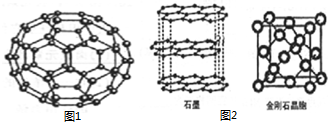 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.

 .
. .
. .
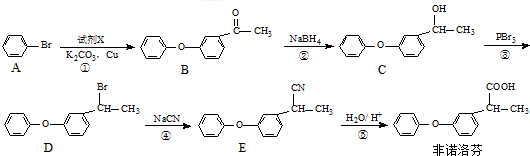
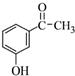
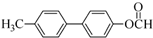
.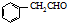 为原料制备
为原料制备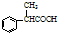 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.