题目内容
3.区别SO2气体和CO2气体的方法是( )| A. | 通入澄清石灰水 | B. | 用品红溶液 | ||
| C. | 用湿润的蓝色石蕊试纸 | D. | 根据有无毒性 |
分析 SO2和CO2气体均为酸性氧化物,但SO2具有漂白性和还原性,以此来解答.
解答 解:A.二者均使石灰水变浑浊,现象相同,不能鉴别,故A不选;
B.二氧化硫可使品红褪色,而二氧化碳不能,现象不同,可鉴别,故B选;
C.二者均为酸性氧化物,都可使试纸变红,不能鉴别,故C不选;
D.二氧化硫有毒,二氧化碳无毒,但不能利用毒性鉴别,故D不选.
故选B.
点评 本题考查二氧化硫的化学性质及物质鉴别,为高频考点,把握酸性氧化物的性质及二氧化硫的漂白性为解答的关键,注意二者性质的差异,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
13.某元素原子核外M层电子数是L层电子数的一半,则此元素是( )
| A. | Li | B. | C | C. | Si | D. | S |
14.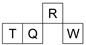 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 原子半径:T>Q>R | |
| C. | 最高价氧化物对应水化物的酸性:Q<W | |
| D. | 含T元素的盐溶液一定显酸性 |
18.银氨溶液可用于检测CO气体,实验室研究的装置如图:
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的脱水性性.
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
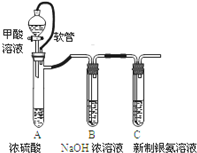 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
15.能证明BF3为平面三角形而不是三角锥形分子的理由是( )
| A. | BF2Cl只有一种结构 | B. | 三根B-F键间键角都为120° | ||
| C. | BFCl2只有一种结构 | D. | 三根B-F键键长都为130pm |
12. 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
(1)写出A中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
采用可抽动铜丝进行实验的优点是可以控制反应的进行.
(2)反应一段时间后,可观察到B试管中的现象为变红.
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是NH3、
Cl2.(要求填一种化合物和一种单质的化学式)
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是过滤.该黑色不溶物不可能是CuO,理由是CuO会溶于稀硫酸中.
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
①根据实验现象可判断黑色不溶物中一定含有硫元素.
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为Cu2S.
 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:完成下列填空:
(1)写出A中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
采用可抽动铜丝进行实验的优点是可以控制反应的进行.
(2)反应一段时间后,可观察到B试管中的现象为变红.
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是NH3、
Cl2.(要求填一种化合物和一种单质的化学式)
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是过滤.该黑色不溶物不可能是CuO,理由是CuO会溶于稀硫酸中.
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
| 实验装置 | 实验现象 |
 | 品红褪色 |
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为Cu2S.



 ,F的结构简式
,F的结构简式 .
.
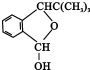 .
.