题目内容
12.氯铝电池是一种新型的燃料电池,电解质溶液是KOH溶液.试回答下列问题:(1)通入氯气的电极是正极(填“正”或“负”);
(2)铝电极是负极(填“正”或“负”);
(3)电子从Al(填“Al”或“Cl2”,下同)电极流向Cl2的电极.
分析 原电池原理即有氧化还原反应发生,且失去电子的为负极,化合价升高,电子流出,得到电子的一极为正极,化合价降低,电子流入,据此解答即可.
解答 解:(1)依据分析可知,通入氯气的电极是正极,氯气在正极上得到电子,被还原成氯离子,电极反应方程式为:3Cl2+6e-=6Cl-,故答案为:正;
(2)加入铝的电极是负极,由于此溶液为KOH,故电极反应方程式为:2Al-6e-+8OH-=2AlO2-+4H2O,故答案为:负;
(3)原电池中电子从负极流出经过导线流到正极,故答案为:Al;Cl2.
点评 本题考查学生原电池的工作原理,属于基础知识的考查,难度不大,注意对基础知识的学习和积累.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
6.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外).Z与W、W与Q的原子序数之差均为3,五种元素原子的最外层电子数之和为21,下列说法正确的是( )
| A. | Z、W、Q三种元素的单质属于三种不同的晶体类型 | |
| B. | Q氢化物的熔点高于Z氢化物的熔点 | |
| C. | 一定条件下,Q单质可把Y从其氢化物中置换出来 | |
| D. | 最高价氧化物对应水化物的酸性顺序:Q>Y>W>X |
3.常温下,体积相同,pH相同的盐酸和醋酸两种溶液中,下列两者的量相同的是( )
| A. | 电离程度 | B. | 酸的物质的量浓度 | ||
| C. | 与Zn反应开始时的反应速率 | D. | 与足量的Zn反应产生H2量 |
7.在一定条件下不能和SiO2发生反应的是( )
| A. | CaCO3 | B. | C | C. | NaOH溶液 | D. | 浓硫酸 |
2.下列反应的离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铜粉与稀硝酸的反应:Cu+2H+═Cu2++H2↑ | |
| C. | 氢氧化铜与稀盐酸反应:OH-+H+═H2O | |
| D. | 碳酸钠溶液与足量稀硫酸的反应:CO32-+2H+═H2O+CO2↑ |

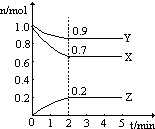 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,