题目内容
12.以黄铁矿为原料生产硫酸的工艺流程图如下:
(1)沸腾炉中发生的反应方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2.
(2)接触室中发生反应的化学方程式是2SO2+O2$?_{△}^{催化剂}$ 2SO3、
(3)依据工艺流程图判断下列说法正确的是abd(填字母).
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐.
SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是SO2+Br2+2H2O═4H++2Br-+SO42-.
分析 (1)沸腾炉中是黄铁矿与氧气在高温下反应;
(2)接触室内的反应是二氧化硫的催化氧化;
(3)依据影响反应速率的因素和平衡移动的影响因素分析解答;
(4)二氧化硫吸收溴单质利用的是二氧化硫的还原性和溴单质的氧化性;根据氧化还原反应书写离子方程式.
解答 解:(1)沸腾炉中是黄铁矿与氧气在高温下反应生成三氧化二铁和二氧化硫,4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 ;
(2)沸腾炉中生成的二氧化硫气体和空气中的氧气在接触室内发生的催化氧化反应生成三氧化硫,2SO2+O2$?_{△}^{催化剂}$ 2SO3,故答案为:2SO2+O2$?_{△}^{催化剂}$ 2SO3;
(3)粉碎矿石增大接触面积提高反应速率;增加空气的量会使平衡正向进行,提高了二氧化硫的转化率;催化剂只改变速率不改变平衡,不改变转化率;生产过程中的矿渣中含有三氧化二铁;所以正确的是abd,故答案为:abd;
(4)SO2吸收Br2的反应中二氧化硫被氧化为硫酸,溴单质被还原为溴化氢,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-.
点评 本题考查了工业制硫酸的基本原理,考查化学平衡的影响因素和化学反应速率的影响因素,以及氧化还原反应离子方程式的书写,难度适中.

练习册系列答案
相关题目
17.下列有关饱和Na2CO3溶液的叙述正确的是( )
| A. | 该溶液中H+、NH4+、NO3-、Al3+可以大量共存 | |
| B. | 该溶液中通入足量CO2气体无明显现象 | |
| C. | 用该溶液浸泡锅炉中的水垢,可使硫酸钙转化为碳酸钙 | |
| D. | 与苯酚溶液反应的离子方程式为:2C6H5OH+CO32-→2C6H5O-+H2O+CO2↑ |
1.下列关系不正确的是( )
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 原子半径:Na>P>O>F | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 金属性:Rb>K>Mg>Al |
2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p4; ③1s22s22p5
则下列有关比较中不正确的是( )
则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 第一电离能:③>②>① |
 Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14) ;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.
;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.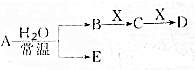 已知A、B、C、D、E、X的转化关系如图所示:
已知A、B、C、D、E、X的转化关系如图所示: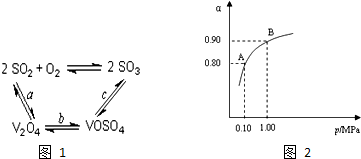 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
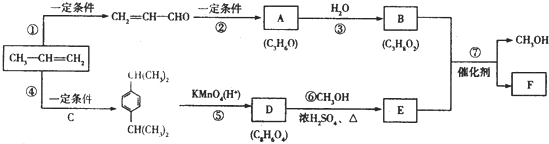
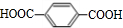 ;F的结构简式为
;F的结构简式为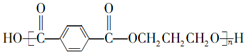 .
.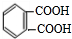 .
.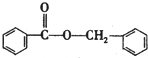 )的合成路线
)的合成路线 .
.