题目内容
2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p4; ③1s22s22p5则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 第一电离能:③>②>① |
分析 由四种元素基态原子电子排布式可知,、①1s22s22p63s23p2是Si元素,②1s22s22p63s23p4为S元素,③1s22s22p5为F元素,
A、最高正化合价等于最外层电子数,但F元素没有正化合价;
B、根据同周期自左而右原子半径减小、电子层越多原子半径越大分析判断;
C、同周期自左而右电负性增大,非金属性越强电负性越大;
D、同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,注意全满、半满稳定状态.
解答 解:由四种元素基态原子电子排布式可知,①1s22s22p63s23p2是Si元素,②1s22s22p63s23p4为S元素,③1s22s22p5为F元素,
A、最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:③>②>①,故A正确;
B、同周期自左而右原子半径减小,电子层越多原子半径越大,所以原子半径Si>S>F,故B错误;
C、同周期自左而右电负性增大,同主族从上到下电负性减弱,所以电负性Si<S<F,故C错误;
D、同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能降低,所以第一电离能Si<S<F,故D错误.
故选A.
点评 本题考查核外电子排布规律、元素周期律等,难度不大,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素.

练习册系列答案
相关题目
13.化学与社会、生活和生产息息相关,以下叙述不正确的是( )
| A. | 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜 | |
| C. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| D. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等 |
10.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
17.标准状况下,在干燥的烧瓶中充满纯净的NH3进行如图所示的喷泉实验下列说法错误的是( )
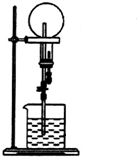

| A. | 若烧瓶的氨气中混有少量氮气,则喷泉实验后的水不能充满烧瓶 | |
| B. | 本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差 | |
| C. | 本实验若将NH3换成Cl2,烧杯中水换成饱和食盐水,也能产生喷泉 | |
| D. | 实验结束后烧瓶中氨水的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 |
7.下列各组指定的元素,不能形成AB2型共价化合物的是( )
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p2 | C. | 3s2和3s23p5 | D. | 2s22p3和2s22p4 |
14.如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )


| A. | WX3和水反应形成的化合物是共价化合物 | |
| B. | 单质的熔点:Y>Z | |
| C. | X、Y、R形成的某种化合物可以用于漂白、消毒 | |
| D. | Y、Z和W三者最高价氧化物对应的水化物能两两相互反应 |
12.沼气是一种能源,它的主要成分是CH4.0.5mol CH4完全燃烧生成CO2和H2O时,放出445KJ热量,则下列热化学方程式正确的( )
| A. | 2CH4 (g)+4O2(g)=2CO2(g)+4H2O(l)△H=+890KJ/mol | |
| B. | CH4+2O2=CO2+2H2O△H=-890KJ/mol | |
| C. | CH4 (g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ/mol | |
| D. | $\frac{1}{2}$CH4 (g)+O2(g)=1$\frac{1}{2}$CO2(g)+H2O(l)△H=-890KJ/mol. |

 .
.