题目内容
将 11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g,求原气体混合物中乙烯与乙烷的物质的量之比和质量比.
考点:有关混合物反应的计算
专题:
分析:根据乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,再根据n=
=
计算物质的量、质量关系.
| m |
| M |
| V |
| Vm |
解答:
解:11.2L混合气体的物质的量为:n=
=0.5mol,
乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为:n=
=0.3mol,
则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,
所以乙烯与乙烷的物质的量之比为0.3mol:0.2mol=3:2,质量之比为:8.4g:6g=7:5,
答:原气体混合物中乙烯与乙烷的物质的量之比为3:2,质量之比为7:5.
| 11.2L |
| 22.4L/mol |
乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了8.4g,即为乙烯的质量,所以乙烯的物质的量为:n=
| 8.4g |
| 28g/mol |
则乙烷的物质的量为:0.5mol-0.3mol=0.2mol,质量为:0.2mol×30g/mol=6g,
所以乙烯与乙烷的物质的量之比为0.3mol:0.2mol=3:2,质量之比为:8.4g:6g=7:5,
答:原气体混合物中乙烯与乙烷的物质的量之比为3:2,质量之比为7:5.
点评:本题考查混合物的计算,题目难度中等,明确乙烯与乙烷的性质差别是解题的关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积等物理量之间的转化关系.

练习册系列答案
相关题目
下列过程没有发生化学反应的是( )
| A、用氢氟酸来刻蚀玻璃器皿 |
| B、用活性炭去除冰箱中的异味 |
| C、用煤液化和气化得到清洁燃料 |
| D、用热碱溶液清除炊具上残留的油污 |
用酸性氢氧燃料电池(乙池)为电源进行电解的实验装置(甲池,一定条件下可实现有机物的电化学储氢)如下图所示.甲池中A为含苯的物质的量分数为10%的混合气体,B为10mol混合气体其中苯的物质的量分数为24%,C为标准状况下2.8mol气体(忽略水蒸汽),下列说法不正确的是( )
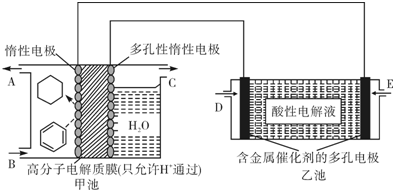

| A、乙池中溶液的pH变大 |
| B、E处通入H2,C处有O2放出 |
| C、甲池中阴极区只有苯被还原 |
| D、导线中共传导11.2mol电子 |
室温时,关于溶液的下列说法正确的是( )
| A、c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |